题目内容
【题目】下列实验现象及所得结论均正确的是( )
实验 | 实验现象 | 结论 |
A. | 左侧试管比右侧试管中产生气泡的速率快 | Fe3+对H2O2分解的催化效果更好 |
B. | 左侧棉花变为橙色,右侧棉花变为蓝色 | 氧化性:Cl2>Br2> I2 |
C. | U形管左端液面下降,右端液面上升 | NH4NO3溶解吸热 |
D. | 烧杯中产生白色沉淀 | 甲烷与氯气光照条件下发生取代反应 |
A.AB.BC.CD.D
【答案】A
【解析】
A.等量同浓度的双氧水中分别滴入相同体积含相同浓度的Fe3+和Cu2+的溶液,滴入Fe3+的试管中产生气泡的速率快,说明Fe3+对H2O2的分解的催化效果更好,故A正确;
B.氯气从左侧通入,先接触到吸有NaBr溶液的棉花,棉花变橙色,说明Cl2和NaBr发生了置换反应:Cl2+2NaBr=Br2+2NaCl,说明氧化性:Cl2>Br2。右侧的棉花吸有淀粉碘化钾溶液,右侧棉花变蓝,说明有I2生成。I2的生成可能是左侧棉花上产生的Br2挥发到右侧棉花上置换出了I2,也可能是通入的Cl2和KI反应置换出了I2,所以无法说明Br2和I2的氧化性相对强弱,故B错误;
C.NH4NO3溶解吸热,使试管内空气遇冷体积减小,试管内压强降低,U形管左端液面上升,右端液面下降,故C错误;
D.甲烷和氯气发生取代反应生成HCl,可以和AgNO3溶液生成AgCl白色沉淀,但未被消耗的氯气也会进入AgNO3溶液中,和AgNO3反应生成白色沉淀,故根据烧杯中产生白色沉淀不能证明甲烷和氯气在光照条件下发生取代反应,故D错误;
故选A。

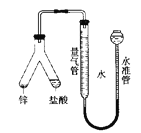
【题目】在“测定1mol气体体积”的实验中,我们通常选择的测量气体是氢气,反应是镁和稀硫酸反应。图中的A、B、C三部分能组成气体摩尔体积测定装置:

(1)C装置的名称是___________________。
(2)A、B、C装置接口的连续顺序是_________________。
(3)该装置正确连接后怎样做气密性检查?_________________。
(4)本实验中有两次针筒抽气,需要记录的是第____次抽出气体的体积。
(5)下表是某同学记录的实验数据:温度:25℃,气压:101.3kPa
实验次数 | 镁带质量(g) | 硫酸体积(mL) | C瓶读数(mL) | 抽出气体的体积(mL) |
1 | 0.115 | 10.0 | 124.8 | 7.0 |
2 | 0.110 | 10.0 | 120.7 | 6.2 |
计算两次实验1mol氢气的体积的平均值=____L(保留一位小数,镁的相对原子质量为24.3)。
(6)已知实验温度下,1mol氢气的体积的理论值为24.5L,实验误差=____%(保留三位有效数字)。
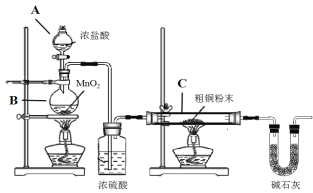
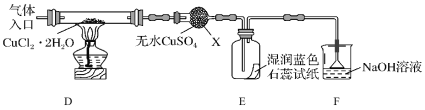
【题目】无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,实验室可用熔融的锡(熔点231℃)与Cl2反应制备SnCl4,装置如图所示,请回答下列问题:
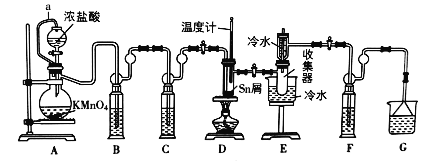
已知,SnCl4在潮湿的空气中极易水解生成SnO2xH2O。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)导管a的作用是______,装置A中发生反应的化学方程式为______。
(2)装置B、C、F、G中盛放的最佳试剂依次为______(填序号,试剂可重复使用),
①饱和Na2CO3溶液②NaOH溶液③浓H2SO4④饱和NaCl溶液⑤H2O
(3)点燃酒精灯前需要进行的一步操作是______。
(4)若撤去装置C,则D中发生的主要副反应化学方程式为______。
(5)得到的产物中常含有SnCl2,某实验小组用碘氧化法滴定分析产品中SnCl4的含量(Sn2++I2=Sn4++2I-)。准确称取该样品mg放入锥形瓶中,用少量浓盐酸溶解,再加水稀释,淀粉溶液作指示剂,用0.1molL-1碘标准溶液滴定至终点时锥形瓶内溶液颜色变化是______,若消耗标准液20.00mL,则产品中SnCl4的质量含量为______(用含m的代数式表示)