题目内容
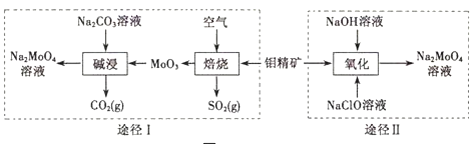
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
(1)钼和锆同属过渡金属,锆元素是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是______(填序号)
A 锆合金比纯锆的熔点高,硬度小
B 二氧化锆陶瓷属于新型无机非金属材料
C 将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)①途径I碱浸时发生反应的离子方程式为______.
②途径Ⅱ氧化时发生反应的离子方程式为______.
(3)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是______.
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:
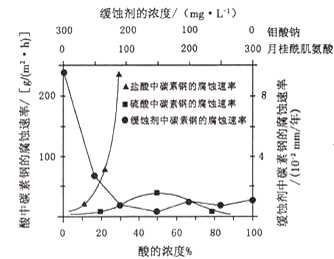
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为______。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是______。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
【答案】B MoO3+CO32-=MoO42-+CO2↑ MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O (NH4)2CO3或(NH4)2SO3 1:1 常温下浓硫酸具有强氧化性,会使铁钝化 nMoS2+xLi++xe-=Lix(MoS2)n ![]()
【解析】
(1)合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的物质,合金的硬度大,熔点低,陶瓷属于无机非金属材料,二氧化锆为化合物无丁达尔效应;
(2)①途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,得到钼酸钠和NaCl和水,据此可写出离子反应方程式;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,将NH3和CO2或SO2一起通入水中可生成碳酸盐或亚硫酸盐和水,反应方程式为CO2+2NH3+H2O=(NH4)2CO3或NH3+H2O+CO2=NH4HCO3,前者生成的盐为正盐,后者为酸式盐;
(4)①根据图象分析,在缓蚀剂中碳钢的腐蚀速率速率最小,腐蚀效果最好,最好的腐蚀效果在中点处;
②浓硫酸有强氧化性,能使金属表面形成致密的氧化膜保护层;
(5)根据电池放电时的正极MoS2得电子发生还原反应书写;利用途径I,使所有的Mo转化为钼酸钠晶体,根据得失电子守恒计算。
(1)A.合金是指由一种金属与其它金属或非金属熔合而成的具有金属特性的混合物.一般说来合金的硬度一般比各成分金属大,多数合金的熔点低于组成它的成分金属的熔点,所以锆合金比纯锆的熔点低,硬度大,故 A错误;
B.陶瓷属于无机非金属材料,二氧化锆陶瓷属于新型无机非金属材料,故B正确;
C.将一束光线通过胶体会产生一条光亮的通路,但二氧化锆为化合物无丁达尔效应,故C错误;
B正确,故答案为:B;
(2)①途径I碱浸时发生反应的离子方程式为MoO3+CO32-=MnO42-+CO2↑,故答案为:MoO3+CO32-=MoO42-+CO2↑;
②途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,故答案为:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(3)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,CO2和NH3一起通入水中生成的正盐为碳酸铵,化学式为(NH4)2CO3,如果是SO2气体则生成正盐为(NH4)2SO3,故答案为:(NH4)2CO3或(NH4)2SO3;
(4)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1,答案为:1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,故答案为:常温下浓硫酸具有强氧化性,会使铁钝化;
(5)放电时,正极应是发生还原反应的,从总反应式中找到发生还原反应的物质为MoS2,而被还原的产物为Lix(MoS2)n,则电极反应式为:nMoS2+xLi++xe-=Lix(MoS2)n,a克的Na2MoO42H2O(分子量为M)中Mo的物质的量为![]() mol,途径I用Lix(MoS2)n,被空气氧化成MoO3,根据电子得失守恒有关系式
mol,途径I用Lix(MoS2)n,被空气氧化成MoO3,根据电子得失守恒有关系式![]() O2~nMoO3,所以需要需要空气(含O2为20%)在标况下的体积为
O2~nMoO3,所以需要需要空气(含O2为20%)在标况下的体积为![]() =
=![]() L,故答案为:nMoS2+xLi++xe-=Lix(MoS2)n;
L,故答案为:nMoS2+xLi++xe-=Lix(MoS2)n;![]() 。
。

【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)=2NO2(g)△H,上述反应分两步完成,其反应历程如下图所示:
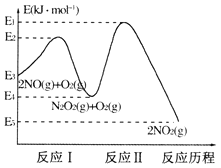
回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应II中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)=2NO2(g)反应速率的是 _______(填“反应I”或“反应II”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及l0 min和20 min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及l0 min和20 min各物质平衡浓度如表所示:
浓度/mol/L 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.040 | 0.030 | 0.030 |
20 | 0.032 | 0.034 | 0.017 |
①T℃时,该反应的平衡常数为 ________ (保留两位有效数字)。
②在l0 min时,若只改变某一条件使平衡发生移动,20 min时重新达到平衡,则改变的条件是________
③在20 min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正____v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
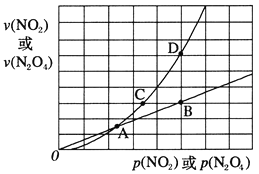
一定温度下,k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____;在上图标出点中,指出能表示反应达到平衡状态的点是 ______。
【题目】我国是最早发现并使用青铜器的国家,后母戊鼎是我国的一级文物,是世界上出土的最大最重的青铜礼器。现代社会中铜的应用常广泛,铜的回收再利用是化工生产的一个重要领域。实验室利用废旧电池的铜帽![]() 、Zn总含量约为
、Zn总含量约为![]() 回收Cu并制备ZnO的部分实验过程如下:
回收Cu并制备ZnO的部分实验过程如下:

请回答下列问题:
(1)请写出一种加快铜帽溶解的方法:______。铜帽溶解时通入空气的作用是______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
(2)调节溶液pH时,是将溶液的pH调______![]() 填“大”或“小”
填“大”或“小”![]() 到
到![]() 。
。
(3)电解精炼粗铜时,阴极的电极反应式为______。工业上常釆用甲醇燃料电池作为电解精炼铜旳电源,写岀碱性甲醇燃料电池的负极反应式:______。
(4)已知:![]() 吋,
吋,![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 。室温下,几种离子生成氢氧化物沉淀的pH如下表所小
。室温下,几种离子生成氢氧化物沉淀的pH如下表所小![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() :
:
|
|
|
| |
开始沉淀的pH | 2 |
|
|
|
沉淀完全的pH |
|
|
|
①表中![]() 沉淀完全的pH为______。
沉淀完全的pH为______。
②由过滤粗铜的滤液制备ZnO的实验步骤依次为![]() 可选用的试剂:
可选用的试剂:![]() 、稀硝酸、
、稀硝酸、![]() 溶液
溶液![]() :
:
![]() ______;
______;
![]() ______;
______;
![]() 过滤;
过滤;
![]() ______;
______;
![]() 过滤、洗涤、干燥;
过滤、洗涤、干燥;
![]() 煅烧。
煅烧。