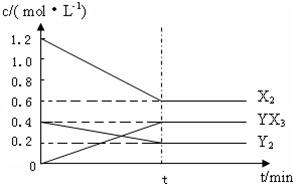
题目内容
(1)求2min内,H2的平均反应速率.
(2)求2min时N2的转化率.
(3)2min时,求容器内气体的压强与反应前气体压强的比值.(写出计算过程)

2NH3,则v(H2)=
| 3 |
| 2 |
| 3 |
| 2 |
| ||
| 2min |
答:H2的平均反应速率0.6mol?L-1?min-1;
(2)根据方程式可知,生成4molNH3时消耗2molN2,则N2的转化率为
| 2mol |
| 5mol |
答:2min时N2的转化率为40%;
(3)达到平衡时各物质的物质的量为n(N2)=3mol,n(H2)=2mol,n(NH3)=4mol,则
容器内气体的压强与反应前气体压强的比值为:(3+2+4):(5+8)=9:13,
答:容器内气体的压强与反应前气体压强的比值为9:13.

(8分)一定条件下向容积为20 L的密闭容器中充入1 mol NO2气体,发生反应2NO2 N2O4。反应中测得相关数据如下表所示:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
(1)此条件下该反应的化学平衡常数Kc=________。(填表达式)
(2)在50 min末,向容器中加入 mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
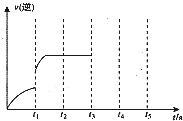
(3)若保持容器体积不发生变化,升高温度,则可得如图图像,据此判断该反应ΔH________0(填“大于”、“小于”或“等于”)。
(4)若在体积不变的情况下,开始充入0.5 mol N2O4,则达到新平衡时N2O4的转化率α=________。
(8分)一定条件下向容积为20 L的密闭容器中充入1 mol NO2气体,发生反应2NO2? ?N2O4。反应中测得相关数据如下表所示:
?N2O4。反应中测得相关数据如下表所示:
|
反应时间/min |
0 |
10 |
20 |
30 |
40 |
50 |
|
气体相对分子质量 |
46 |
57 |
64 |
69 |
69 |
69 |
(1)此条件下该反应的化学平衡常数Kc =________。
(2)在50 min末,向容器中加入2/3 mol NO2,若要保持平衡不发生移动, 则应加入N2O4________mol。
(3)若保持容器体积不发生变化,升高温度,则可得如图图像,据此判断该反应ΔH________0(填“大于”、“小于”或“等于”)。

(4)若在体积不变的情况下,开始充入0.5 mol N2O4,则达到新平衡时N2O4的转化率=________。
X、Y为两种主族元素,原子序数X小于Y,它们与元素Se三种元素原子序数之和为56。已知:X有两种氧化物M和N。Y与Se是相邻周期同主族元素,其中Se可以从电解精炼铜的阳极泥中获得。从阳极泥中提取Se的流程如下:

回答下列问题:(各元素用相应的元素符号表示)
⑴写出X和Y形成的化合物的电子式 。
⑵阳极泥中Se以单质、Ag2Se、Cu2Se等形式存在。写出①中Se单质与浓硫酸反
应的化学方程式
⑶写出反应②的化学方程式为 。
⑷某温度下在容积固定的密闭容器中,下列反应达到平衡:
M(g)+H2O(g) N(g)+H2(g)
N(g)+H2(g)
|
n(M):n(H2O) |
M转化率 |
H2O转化率 |
|
1:1 |
0.5 |
0.5 |
|
1:2 |
0.67 |
0.335 |
|
1:3 |
0.75 |
0.25 |
①已知M和H2的燃烧热分别为283kJ/mol、285.8kJ/mol,H2O(g)=H2O(l)△H=
—44kJ/mol,写出上述反应的热化学方程式 。
②该反应的平衡常数为 。该温度下,向容器中充入1molM、3mol H2O、
2mol N、1.5molH2,则起始时该反应速率V正 V逆(填“>”、“<”或“=”)
③结合表中数据判断下列说法中正确的是
A.增加H2O(g)的量,M的转化率升高而H2O(g)的转化率降低
B.若M与H2O(g)的转化率相同时,二者的初始投入量一定相同
C.M和H2O(g)初始物质的量之比等于二者转化率之比
D.当M与H2O(g)物质的之比为1:4时,M的转化率为0.85
 (2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.
(2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.