题目内容
下列对各种体系的叙述中,不正确的是( )A.在含FeCl2杂质的FeCl3溶液中通入足量C12后,充分加热除去过量Cl2,得到较纯净的FeCl3溶液
B.一定浓度的醋酸钠溶液可使酚酞试液变红,其原因是溶液中存在如下平衡:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
C.常温下,在醋酸溶液中加入少量的CH3COONa固体,会使其电离平衡逆向移动
D.处理锅炉水垢中的CaSO4时,先用饱和Na2CO3溶液处理,再加入盐酸,水垢就会溶解
【答案】分析:A、由于FeCl3溶液中铁离子水解,配制氯化铁溶液时必须加入盐酸;
B、醋酸是弱电解质,醋酸根在溶液中发生水解,溶液显示碱性;
C、加入醋酸钠,溶液中醋酸根浓度增大,平衡逆向移动;
D、碳酸钙的溶解度小于硫酸钙的,硫酸钙不溶于盐酸,但是碳酸钙溶液盐酸.
解答:解:A、由于氯化铁中的铁离子发生水解,生成了氢氧化铁,故得不到较纯净的FeCl3溶液,故A错误;
B、由于醋酸钠溶液中的醋酸根发生水解,结合了水电离的氢离子,溶液显示碱性,反应为CH3COO-+H2O?CH3COOH+OH-,故B正确;
C、加入少量的CH3COONa固体,溶液中的醋酸根浓度增大,醋酸的电离平衡逆向移动,电离程度减小,故C正确;
D、由于硫酸钙是微溶物,且不溶于盐酸,故加入碳酸钠,是硫酸钙转化成更难溶的碳酸钙,就可以用盐酸除掉,故D正确;
故选A.
点评:本题考查了弱电解质的电离平衡、难溶物的溶解平衡等知识,注意配制氯化铁用稀盐酸溶液配制,难度中等.
B、醋酸是弱电解质,醋酸根在溶液中发生水解,溶液显示碱性;
C、加入醋酸钠,溶液中醋酸根浓度增大,平衡逆向移动;
D、碳酸钙的溶解度小于硫酸钙的,硫酸钙不溶于盐酸,但是碳酸钙溶液盐酸.
解答:解:A、由于氯化铁中的铁离子发生水解,生成了氢氧化铁,故得不到较纯净的FeCl3溶液,故A错误;
B、由于醋酸钠溶液中的醋酸根发生水解,结合了水电离的氢离子,溶液显示碱性,反应为CH3COO-+H2O?CH3COOH+OH-,故B正确;
C、加入少量的CH3COONa固体,溶液中的醋酸根浓度增大,醋酸的电离平衡逆向移动,电离程度减小,故C正确;
D、由于硫酸钙是微溶物,且不溶于盐酸,故加入碳酸钠,是硫酸钙转化成更难溶的碳酸钙,就可以用盐酸除掉,故D正确;
故选A.
点评:本题考查了弱电解质的电离平衡、难溶物的溶解平衡等知识,注意配制氯化铁用稀盐酸溶液配制,难度中等.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)
CH3COOH+OH-,使得溶液中的c(OH-)>c(H+)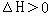 平衡后,升高温度,c(Z)增大
平衡后,升高温度,c(Z)增大