题目内容
Ⅰ(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,表示H2燃烧热的热化学方程式 .
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的反应热为 ,表示其中和热的热化学方程式为 .
Ⅱ、NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为
2CO+2NO=N2+2CO2,为了控制大气污染,提出下列建议:
A.使用催化剂 B.改变压强 C.提高反应温度
你认为可行的方法是 ,理由是 .
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的反应热为
Ⅱ、NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,反应的化学方程式为
2CO+2NO=N2+2CO2,为了控制大气污染,提出下列建议:
A.使用催化剂 B.改变压强 C.提高反应温度
你认为可行的方法是
考点:热化学方程式,有关反应热的计算,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:Ⅰ、(1)根据燃烧热指1mol可燃物完全燃烧生成稳定的化合物时所放出的热量以即反应中的热量与物质的量成正比来解答;
(2)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
Ⅱ、NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,为控制大气污染使用催化剂加快反应速率,加压,升温对汽车尾气处理不符合.
(2)根据中和热的概念:稀的强酸和强碱反应生成1mol水所放出的热量求出中和热以及中和热的热化学方程式;
Ⅱ、NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,为控制大气污染使用催化剂加快反应速率,加压,升温对汽车尾气处理不符合.
解答:
解:Ⅰ、(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O,放出571.6kJ的热量,即2mol氢气完全燃烧放出571.6kJ的热量,则1mol氢气完全燃烧放出的燃量为285.8KJ,所以氢气的燃烧热为-285.8KJ/mol,氢气和氧气都是气态,水是液态,则氢气的燃烧热的热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-285.8KJ/mol,
故答案为:H2(g)+
O2(g)=H2O(l)△H=-285.8KJ/mol;
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+
H2SO4(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:-114.6kJ/mol;NaOH(aq)+
H2SO4(aq)=
Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
Ⅱ、NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,2CO+2NO=N2+2CO2,为了控制大气污染加快反应速率,催化剂能够降低反应的活化能,成千上万倍提高反应速率,使得缓慢发生的2CO+2NO=N2+2CO2反应迅速进行,给导出的汽车尾气再加压、升温的想法不合乎实际;
故答案为:A;催化剂能够降低反应的活化能,成千上万倍提高反应速率,使得缓慢发生的2CO+2NO=N2+2CO2反应迅速进行.给导出的汽车尾气再加压、升温的想法不合乎实际.
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,即生成2mol水放出114.6kJ的热量,反应的反应热为-11.46kJ/mol,中和热为-57.3kJ/mol,则中和热的热化学方程式:NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:-114.6kJ/mol;NaOH(aq)+
| 1 |
| 2 |
| 1 |
| 2 |
Ⅱ、NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,2CO+2NO=N2+2CO2,为了控制大气污染加快反应速率,催化剂能够降低反应的活化能,成千上万倍提高反应速率,使得缓慢发生的2CO+2NO=N2+2CO2反应迅速进行,给导出的汽车尾气再加压、升温的想法不合乎实际;
故答案为:A;催化剂能够降低反应的活化能,成千上万倍提高反应速率,使得缓慢发生的2CO+2NO=N2+2CO2反应迅速进行.给导出的汽车尾气再加压、升温的想法不合乎实际.
点评:本题考查了热化学方程式书写方法,中和热概念的理解应用,化学平衡影响因素分析判断,掌握基础是关键,题目难度不大.

练习册系列答案
相关题目
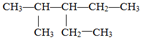 的名称是
的名称是 (1)有甲、乙两容器,甲的容积固定,乙的容积可变.在一定温度下,向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3物质的量为amol.
(1)有甲、乙两容器,甲的容积固定,乙的容积可变.在一定温度下,向甲中通入3molN2和4molH2,反应达到平衡时,生成NH3物质的量为amol. 用50mL0.25mol/L H2SO4与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.
用50mL0.25mol/L H2SO4与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.