题目内容
6.偏铝酸钠溶液中加少量盐酸离子方程式为AlO2-+H++H2O=Al(OH)3↓.分析 偏铝酸钠溶液与少量的盐酸后,偏铝酸根离子与氢离子反应生成氢氧化铝沉淀,据此写出反应的离子方程式.
解答 解:往偏铝酸钠溶液中加入少量的稀盐酸,产生白色胶状的氢氧化铝沉淀,反应的离子方程式为:AlO2-+H++H2O=Al(OH)3↓,
故答案为:AlO2-+H++H2O=Al(OH)3↓.
点评 本题考查了离子方程式书写,题目难度中等,注意掌握离子方程式的书写原则,本题侧重基础知识的考查,明确反应物过量情况对生成物的影响为解答关键.

练习册系列答案
相关题目
17.等质量的下列有机物与足量的氧气完全燃烧,消耗氧气最多的是( )
| A. | 丙烯 | B. | 乙炔 | C. | 甲苯 | D. | 甲烷 |
14.向碳酸钠溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液中HCO3-浓度的变化趋势可能是( )
| A. | 逐渐减小 | B. | 逐渐增大 | ||
| C. | 先逐渐增大,后逐渐减小 | D. | 先逐渐减小,后逐渐增大 |
1.在等温、等容条件下,有下列气体反应:2A(g)+2B(g)?C(g)+3D(g).现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2mol/L和6mol/L.下列叙述正确的是( )
| A. | 达到平衡时,Ⅰ途径的反应速率V(A)等于Ⅱ途径的反应速率V(A) | |
| B. | 达到平衡时,第Ⅰ条途径混合气体的密度与第Ⅱ条途径混合气体的密度相同 | |
| C. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同 | |
| D. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数不同 |
11.下列溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | pH=4的0.1 mol•L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-) | |
| C. | 常温下,等物质的量浓度的三种溶液:①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2中c(NH4+):①<③<② | |
| D. | 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) |
15.光化学烟雾是一次污染物(如氮的氧化物、碳氢化合物等)发生光化学反应后生成的二次污染物,主要含有臭氧、过氧硝酸酯等.下列有关光化学烟雾的说法不正确的是( )
| A. | 光化学烟雾具有氧化性 | |
| B. | 汽车尾气是造成光化学烟雾的主要原因之一 | |
| C. | 光化学烟雾对人体没有危害 | |
| D. | 光化学烟雾一般出现在强日照条件下 |
16.法国里昂的科学家最近发现一种只有四个中子构成的粒子,这种粒子称为“四中子”,也有人称其为“零号元素”.下列有关四中子粒子的说法不正确的是( )
| A. | 该粒子不显电性 | B. | 该粒子质量数为4 | ||
| C. | 该粒子的质量数为1 | D. | 该粒子质量比氢原子大 |
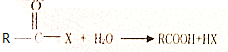
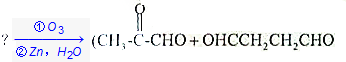

 .
.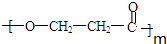 +(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应.
+(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应.