题目内容
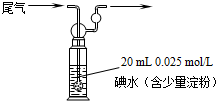
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积.将尾气通入一定体积已知浓度的碘水中测定0氧化硫的含量.当洗气瓶的中溶液蓝色消失时,立即关闭活塞A.
(的)洗气瓶的中导管末端连接一3多孔球泡D,可以提高实验准确度,其理由是:______.
(2)洗气瓶的中的溶液可以用其他试剂替代,请你举出一种:______.
(3)洗气瓶的溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量______(填“偏高”、“偏低”或“无影响”).
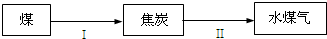
乙方案:实验步骤如以下流程图所示:

(4)写出步骤②中反应的化学方程式______.
(5)步骤③中洗涤沉淀的方法是______.
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中0氧化硫含量(体积分数)为______(用含有V、m的代数式表示).
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同.
(8)你认为丙方案是否合理,说明理由:______.

(1)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
故答案为:增大SO2与碘水的接触面积,使SO2和碘水充分反应;
(2)洗气瓶C中的溶液还可以用酸性高锰酸钾溶液、溴水等代替;
故答案为:酸性高锰酸钾溶液或溴水;
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,因此SO2含量偏低;
故答案为:偏低;
乙方案利用的原理为:SO2+H2O2=H2SO4,H2SO4+Ba(OH)2=BaSO4↓+2H2O,最后沉淀硫酸钡的质量计算尾气中二氧化硫的质量,进而计算尾气二氧化硫含量;
(4)步骤②中反应的化学方程式为:H2SO4+Ba(OH)2=BaSO4↓+2H2O;
故答案为:H2SO4+Ba(OH)2=BaSO4↓+2H2O;
(5)洗涤沉淀的方法是:向漏斗里注入蒸馏水,使水面没过沉淀物,待水流尽后,重复操作2~3次;
故答案为:向漏斗里注入蒸馏水,使水面没过沉淀物,待水流尽后,重复操作2~3次;
(6)mg是硫酸钡的质量,硫酸钡的物质的量为
| mg |
| 233g/mol |
| m |
| 233 |
| m |
| 233 |
| 22.4m |
| 233 |
| ||
| VL |
| 22.4m |
| 233V |
故答案为:
| 22.4m |
| 233V |
丙方案:
(7)将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,BaSO3被部分氧化为BaSO4,导致测定的亚硫酸钡的质量偏大,测定二氧化硫的体积偏大,体积分数偏大,故不合理;
故答案为:不合理,BaSO3被部分氧化为BaSO4.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案(15分)硫酸在日常生产生活中应用非常广泛。请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是 。
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3,是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O21l%;N2 82%);
|
压强/Mpa 转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
利用表中数据分析。在实际生产中选择的适宜生产条件是:温度______ ℃,压强 ___________MPa。
(3)选择适宜的催化剂,是否可以提高SO2的转化率? _______(填“是”或“否”),是否可以增大该反应所放出的热量? (填“是” 或“否”)。
(4)为提高SO3吸收率,实际生产中用 吸收SO3。
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是______(填写序号)。
A.保护环境。防止空气污染 B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率 D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用________(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式_______________________________________。
【化学——选修化学与技术】 (15分)
硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是 。
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3,是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O21l%;N2 82%);
|
转化率/%
温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
利用表中数据分析。在实际生产中选择的适宜生产条件是:温度 ℃,
压强 MPa。
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是” 或“否”)。
(4)为提高SO3吸收率,实际生产中用 吸收SO3。
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是 (填写序号)。
A.保护环境。防止空气污染 B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率 D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用
(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式 。
 压强/Mpa
压强/Mpa