题目内容
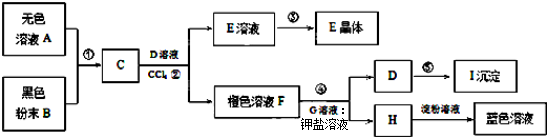
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
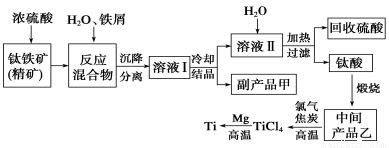
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲阳离子是________。
(2)上述生产流程中加入铁屑的目的是____________________________。
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol·L-1,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:________________________。
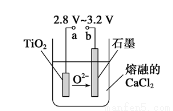
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是__________________。(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图所示。下图中b是电源的________极,阴极的电极反应式________。
练习册系列答案
相关题目
19.有一种基于乙醇酸性燃料电池原理设计的酒精检测仪,其原理是通过将乙醇氧化为乙酸来测定血液中乙醇的含量.下列有关说法正确的是( )
| A. | 电池工作时消耗5.6LO2,转移电子为1mol | |
| B. | 检测时,电解质溶液中的H+向负极移动 | |
| C. | 正极上发生的反应为:O2+4e-+2H2O=4OH- | |
| D. | 负极上发生的反应为:CH3CH2OH-4e-+H2O=CH3COOH+4H+ |
20.我省近年来以铁矿石为原料的产业发展迅猛,下列有关说法正确的是( )
| A. | 以焦炭和铁矿石为原料炼铁的原理是用焦炭直接还原化合态的铁 | |
| B. | 据报道,庐江磁性材料产生“磁”力无穷,磁性氧化铁的化学式是Fe2O3 | |
| C. | 为证明某铁矿石中存在铁离子,可将铁矿石溶于硝酸后,再加KSCN溶液 | |
| D. | 利用铁矿石制得的能除去污水中的,可知相同条件下,Ksp(FeS)>Ksp(HgS) |
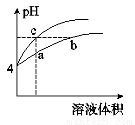
5.已知水的电离平衡曲线如图,下列说法正确的是( )
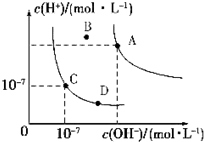

| A. | 水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D) | |
| B. | B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 | |
| C. | 向水中加入醋酸钠固体,可从C点到D点 | |
| D. | 升高温度可实现由C点到D点 |


 NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。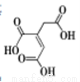
 .
.