题目内容
【题目】“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
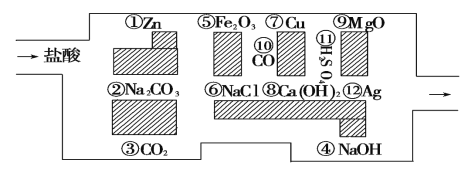
(1)请你帮助它走出迷宫(请用图中物质的序号先后连接起来表示所走的路线)_______________________ 。
(2)迷宫内12种物质中属于碱性氧化物的有 _____,写出其中一种与盐酸反应的离子方程式:_____。
(3)迷宫内 12 种物质中金属单质,按活动性顺序由强到弱是:_________,试写一个相互置换的化学方程式:_____。
【答案】③⑥⑩⑦ ⑤⑨ Fe2O3 +6H+ =2Fe3++3H2O (或 MgO+2H+ =Mg2++H2O) ①⑦ Zn+CuSO4=ZnSO4+Cu (合理即可)
【解析】
盐酸是强酸,能跟金属活动顺序表中氢位前的金属反应如Zn、Fe等,不能跟氢位后的金属如Cu、Ag等反应;盐酸能与弱酸的盐反应如Na2CO3等;盐酸能与碱性氧化物反应如Fe2O3、MgO等;盐酸能与碱发生中和反应如NaOH、Ca(OH)2等,由此分析。
(1)要让盐酸走出迷宫,所经过的物质都不能跟盐酸反应,CO2、NaCl、CO、Cu、H2SO4、Ag都不能跟盐酸反应,所以盐酸所走的路线是:③⑥⑩⑦。
(2)能与酸反应生成盐和水的氧化物称为碱性氧化物,Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O,所以Fe2O3和MgO属于碱性氧化物,即⑤⑨属于碱性氧化物;它们与盐酸反应的离子方程式为Fe2O3 +6H+ =2Fe3++3H2O,MgO+2H+ =Mg2++H2O(任写一个即可)。
(3)根据金属活动顺序表,越靠前的金属越活泼,因此活动性由强到弱的顺序是Zn>Cu>Ag,即活动性由强到弱的顺序是①⑦;它们之间发生置换反应的化学方程式有:Zn+CuSO4=ZnSO4+Cu,Cu+2AgNO3=Cu(NO3)2+2Ag(任写一个即可)。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】将牛奶和姜汁混合,待牛奶凝固便成为一种富有广东特色的甜品——姜撞奶。为了掌握牛奶凝固所需的条件,某同学在不同温度的等量牛奶中混人一些新鲜姜汁,观察混合物15min,看其是否会凝固,结果如下表。请回答下列问题:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
结果 | 15min后仍未有凝固迹象 | 14min内完全凝固 | 1min内完全凝固 | 1min内完全凝固 | 15min后仍未有凝固迹象 |
(注:用曾煮沸的姜汁重复这项实验,牛奶在任何温度下均不能凝固)
(1)实验证明新鲜姜汁中含有一种酶,其作用是 。
(2)20℃和100℃时,15min后仍未有凝固迹象,说明酶的活性较低,其原因分别是 和 。
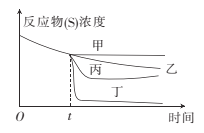
(3)若60℃时牛奶在有姜汁和没有姜汁的情况下都可以凝固,当反应进行到t时,向其中加人姜汁。下图中能正确表示加姜汁后牛奶凝固随时间变化趋势的曲线是 。
(4)为提高实验的准确度,实验中“不同温度的等量牛奶中混入一些新鲜姜汁”操作中应注意的是 。
(5)有同学说,该实验不能得出姜汁使牛奶凝固的最适温度,请提出解决方案: 。