题目内容
13.用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用.例如:光导纤维的主要成分是SiO2(二氧化硅);目前应用最多的太阳能电池的光电转化材料是Si (晶体硅).分析 二氧化硅是光导纤维的成分,而硅太阳能电池的主要成分为硅,由此分析解答.
解答 解:光导纤维的主要成分是二氧化硅,太阳能电池的主要成分为硅单质,故答案为:SiO2(二氧化硅); Si (晶体硅).
点评 本题考查物质的成分和用途,主要是硅及其化合物性质分析,学习中注意知识的积累,题目难度不大.

练习册系列答案
相关题目
19.下列各组溶液只通过相互滴加不能鉴别出来的是( )
| A. | NaAlO2溶液和盐酸 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | NaOH溶液和浓AlCl3溶液 | D. | 稀硫酸和碳酸钠溶液 |
20.下列物质能和水发生化合反应的是( )
| A. | Al2O3 | B. | Na2O2 | C. | MgO | D. | NO2 |
8.氨和铵盐既是实验室常用试剂又是重要化工原料.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.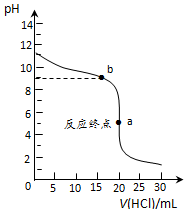
①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O
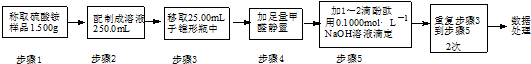
滴定结果如表所示:
试计算该样品中氮元素的质量分数(写出计算过程)计算平均消耗溶液体积V=$\frac{20.01ml+19.99ml+20.00ml}{3}$=20.00ml,
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
(1)氨水的电离方程式为NH3•H2O?NH4++OH-.硫酸铵在水溶液中水解的离子方程式为NH4++H2O?NH3•H2O+H+.
(2)常温下,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水,其滴定曲线如图所示.

①该滴定适宜的指示剂为甲基橙(选填:“甲基橙”、“酚酞”、“石蕊”).
②图中“a”点处溶液中四种离子浓度从大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-).
③已知图中“b”点处,溶液中满足4c(NH4+)=7c(NH3•H2O),则常温时Kb(NH3•H2O)=1.75×10-5(填数值).
(3)实验室常利用甲醛法测定硫酸铵样品中氮元素的质量分数,反应原理为:
4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O

滴定结果如表所示:
| 滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.01 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.30 | 20.30 |
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,.
18.下列实验装置正确的是( )
| A. |  实验室制乙烯 | B. |  酯化反应 | ||
| C. |  实验室制取Cl2 | D. |  中和热的测定 |
3.根据等电子原理判断,下列说法中正确的是( )
| A. | B3N3H6和苯是等电子体,B3N3H6分子中所有原子均不在同一平面上 | |
| B. | NO3-和CO32-是等电子体,均为平面正三角形结构 | |
| C. | H3O+和PCl3是等电子体,均为三角锥形 | |
| D. | CH4和NH4+是等电子体,均为正四面体形,键角均为60° |
