题目内容
【题目】含硫化合物多为重要的化工原料。请回答下列问题:
I.多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。
(1)Na2S2的电子式为___。
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,该反应的离子方程式为___。
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,其煅烧的化学方程式为___。
II.焦亚硫酸钠(Na2S2O5)是一种食品抗氧化剂,易溶于水。
(4)焦亚硫酸钠(Na2S2O5)中硫元素的化合价为___。
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,发生反应的离子方程式为___。
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠,发生反应的化学方程式为___。
III.硫代硫酸钠(Na2S2O3)是一种重要的滴定试剂,常用来滴定溶液中的含碘量。
(7)为测定某碘水中I2的浓度(假设碘水中的碘元素均以碘单质形式存在),取该碘水200.00mL,加入淀粉溶液作为指示剂,滴加0.01mol·L-1硫代硫酸钠标准液,发生反应:I2+2S2O32-=S4O62-+2I-,当___(填实验现象),即为终点。平行滴定3次,标准液的平均用量为20.00mL,则该碘水中I2的浓度为___mg·L-1。
【答案】![]() S52+2H+=H2S↑+4S↓ 4FeS2+11O2
S52+2H+=H2S↑+4S↓ 4FeS2+11O2![]() 2Fe2O3+8SO2 +4 S2O52+O2+H2O=2SO42+2H+ Na2CO3+2SO2=Na2S2O5+CO2 滴入最后一滴硫代硫酸钠标准液,溶液由蓝色变为无色,且30s内不再变蓝 127
2Fe2O3+8SO2 +4 S2O52+O2+H2O=2SO42+2H+ Na2CO3+2SO2=Na2S2O5+CO2 滴入最后一滴硫代硫酸钠标准液,溶液由蓝色变为无色,且30s内不再变蓝 127
【解析】
Ⅰ.(1)Na2S2 是离子化合物,是钠离子和过硫根离子构成;
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S;
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2;
Ⅱ.(4)元素化合价倒数和为0计算得到元素的化合价;
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,Na2S2O5被氧气氧化得到硫酸钠和硫酸;
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠;
Ⅲ.取该碘水200.00mL,加入淀粉溶液作为指示剂,滴加0.01molL-1硫代硫酸钠标准液,发生反应:I2+2S2O32-=S4O62-+2I-,反应终点的现象是滴入最后一滴溶液,蓝色变为无色且半分钟不变,结合化学方程式定量关系计算。
Ⅰ.(1)Na2S2的电子式为![]() ;
;
(2)Na2S5(易溶于水)在酸性条件下可生成H2S和S,反应的离子方程式为S52+2H+=H2S↑+4S↓;
(3)黄铁矿(FeS2)是工业上制硫酸的重要原料,在氧气中煅烧生成Fe2O3和SO2,反应的化学方程式:4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
Ⅱ.(4)焦亚硫酸钠(Na2S2O5)中,钠元素化合价+1价,氧元素化合价2价,化合价代数和为0计算得到硫元素的化合价为+4;
(5)向某些饮料中添加少量焦亚硫酸钠(Na2S2O5),可降低饮料中溶解氧的含量,Na2S2O5被氧气氧化得到硫酸钠和硫酸,反应的离子方程式:S2O52+O2+H2O=2SO42+2H+;
(6)向饱和碳酸钠溶液中通入过量SO2可制得焦亚硫酸钠,反应的化学方程式:Na2CO3+2SO2=Na2S2O5+CO2;
Ⅲ.碘水加入淀粉变蓝色,当消耗完碘单质后溶液变为无色,滴定终点的现象是:当滴入最后一滴硫代硫酸钠标准液后,溶液由蓝色变为无色且半分钟不再变蓝说明反应达到终点,发生反应:I2+2S2O32=S4O62+2I,2×c(I2) ×V(I2)=c(S2O32)×V(S2O32),c(I2)=![]() =0.0005mol/L,0.0005mol/L×127 g/mol×2×1000mg/g=127mg/L。
=0.0005mol/L,0.0005mol/L×127 g/mol×2×1000mg/g=127mg/L。

 期末冲刺100分创新金卷完全试卷系列答案
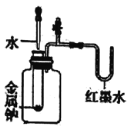
期末冲刺100分创新金卷完全试卷系列答案【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
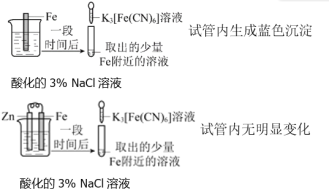
A |
| Zn保护了Fe不被腐蚀 |
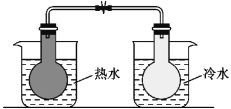
B |
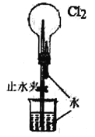
| 2NO2(g) |
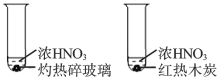
C | 试管内均有红棕色气体生成
| 木炭与浓硝酸发生了反应 |
D | 常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,充分搅拌后过滤,再向洗净的滤渣中加稀盐酸,有气泡产生 | Ksp(BaSO4)>Ksp(BaCO3) |
A. AB. BC. CD. D
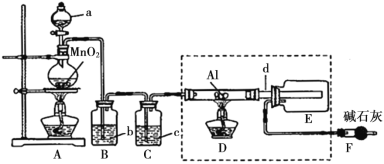
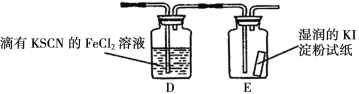
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,不正确的是( )
A.Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=2NO2
B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C.对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化