题目内容
写出下列物质的电子式:
(1)、MgCl2
 (2)、N2
(2)、N2
 (3)、Br2
(3)、Br2
 (4)、CH4
(4)、CH4
 .
.
(1)、MgCl2








分析:MgCl2是离子化合物,电子式中氯离子应写在镁离子的两侧;氮气中有三个共价键,即氮原子间形成三对共用电子对;溴原子间只形成一对共用电子对;甲烷中碳原子分别于4个氢原子形成共用电子对.
解答:(1)镁失去2个电子形成阳离子,氯原子得到电子形成阴离子,电子式为 ,
,
故答案为: ;
;
2)氮原子间形成三对共用电子对,电子式为 ,
,
故答案为: ;
;
(3)溴最外层有7个电子,形成一对共用电子对,电子式为 ,
,
故答案为: ;
;
(4)碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为 ,
,
故答案为: .
.
 ,
,故答案为:
 ;
;2)氮原子间形成三对共用电子对,电子式为
 ,
,故答案为:
 ;
;(3)溴最外层有7个电子,形成一对共用电子对,电子式为
 ,
,故答案为:
 ;
;(4)碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为
 ,
,故答案为:
 .
.点评:考查离子化合物、共价化合物、非金属单质电子式的书写,注意共用电子对的数目.

练习册系列答案
相关题目





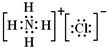




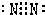







 I2+Z+H2O,其中的R元素.
I2+Z+H2O,其中的R元素.