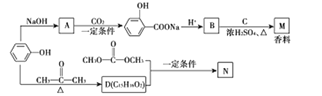
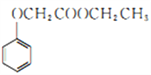题目内容
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出E元素名称:________
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,BC分子的结构式是 ________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是______________。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的价电子排布式是________,在元素周期表中位置是______________,其最高价氧化物的化学式是______________。
【答案】 锰 ![]() σ C≡O SiO2 + 2OH-=SiO32- +H2O O>P>Si>Li 3d54s2 第四周期第ⅦB族 Mn2O7
σ C≡O SiO2 + 2OH-=SiO32- +H2O O>P>Si>Li 3d54s2 第四周期第ⅦB族 Mn2O7
【解析】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布为ms1,A位于ⅠA族;B元素的原子价电子排布式为ns2np2,B位于ⅣA族;C元素位于第二周期且原子中p能级与s能级电子总数相等,则原子的电子排布式为1s22s22p4,故C为氧元素;D元素原子的M能层的P能级中有3个未成对电子,则D元素原子电子排布式为1s22s22p63s23p3,D为P元素;E元素原子有5个未成对电子,则E的电子排布式为:1s22s22p63s23p63d54s2,E为Mn元素。
(1). E是锰元素,故答案为:锰;
(2). 氧是8号元素,基态原子的电子排布图为![]() ,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为氢原子的1s电子与氧原子的2p电子采取“头碰头”的方式成键,属于σ键,故答案为:
,若A为非金属元素,则A为氢元素,与氧元素形成的化合物为水等,共价键为氢原子的1s电子与氧原子的2p电子采取“头碰头”的方式成键,属于σ键,故答案为:![]() ;σ;
;σ;
(3). 当n=2时,B为C元素,CO分子的结构式为:C≡O;当n=3时,B为Si元素,与氧元素形成的化合物是二氧化硅,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,离子方程式为:SiO2 + 2OH-=SiO32- +H2O,故答案为:C≡O ;SiO2 + 2OH-=SiO32- +H2O;
(4). 若A元素的原子最外层电子排布为2s1,则A为Li元素,B元素的原子价电子排布式为3s23p2,B为Si元素,同周期元素自左至右第一电离能呈增大趋势,同主族元素自上而下第一电离能逐渐减小,非金属性越强第一电离能越大,故第一电离能由大到小的顺序为:O>P>Si>Li,故答案为:O>P>Si>Li;
(5). E是锰元素,价电子排布式为:3d54s2,在元素周期表中处于第四周期第ⅦB族,锰元素的最高正化合价为+7价,则其最高价氧化物的化学式是Mn2O7,故答案为:3d54s2;第四周期第ⅦB族;Mn2O7。

 阅读快车系列答案
阅读快车系列答案