题目内容
往
思路解析:解答本题的关键是要分析清楚剩余
解:n(![]() )=n(BaCl2)=2 L×0.25 mol·L-1=0.50 mol
)=n(BaCl2)=2 L×0.25 mol·L-1=0.50 mol
若原混合溶液中溶质全部是CuSO4,由Fe+CuSO4![]() FeSO4+Cu,可知,需Fe质量为:0.5 mol×56 g·mol-1=28 g
FeSO4+Cu,可知,需Fe质量为:0.5 mol×56 g·mol-1=28 g
若原混合溶液中溶质全部是Fe2(SO4)3,由Fe+Fe2(SO4)3=3FeSO4,可知,需Fe质量为:0.5 mol×![]() ×56 g·mol-1=9.33 g
×56 g·mol-1=9.33 g
因而实际需Fe的质量应介于9.33—28 g之间。现加入的Fe为30 g。所以铁粉过量,26 g固体是Fe和Cu的混合物。
设原混合液中Fe2(SO4)3物质的量为x mol,CuSO4的物质的量为y mol
Fe + Fe2(SO4)3![]() 3FeSO4
3FeSO4
x 3x
Fe +CuSO4![]() FeSO4 + Cu △m
FeSO4 + Cu △m
1 8
y 8y
依题意:![]() 解得:
解得:![]()
所以 c[Fe2(SO4)3]=![]() =0.05 mol·L-1
=0.05 mol·L-1
c(CuSO4)=![]() =0.10 mol·L-1
=0.10 mol·L-1
答案:0.05 mol·L-1,0.10 mol·L-1。

练习册系列答案
相关题目
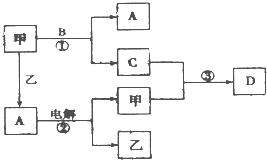 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系: