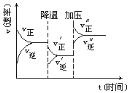
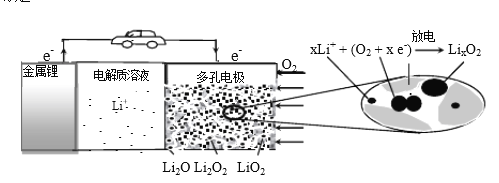
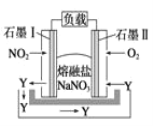
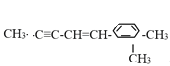题目内容
【题目】25℃,浓度都是1mol/L的四种正盐溶液,其pH情况如下:
AX | BX | AY | BY |
pH=7,c(X-)=1mol/L | pH=4 | pH=6 |
(1)AY溶液pH______7 (填“>”、“<”或“=”);
(2)将等浓度的HX、HY稀释相同的倍数,溶液的pH变化幅度:HX______HY;若将等体积、等pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH______BOH(均填“>”、“<”或“=”);
(3)在BX溶液中:c(B+)+c(H+)-c(OH-)=________mol/L;在AY溶液中:c(A+)-c(Y-)=___________(用两项表示);
【答案】> > < 1mol/L c(OH-)-c(H+)
【解析】
![]() 的溶液pH=7且c(X-)=1mol/L,说明
的溶液pH=7且c(X-)=1mol/L,说明![]() 是强酸,
是强酸,![]() 是强碱,
是强碱,![]() 溶液pH=4,
溶液pH=4,![]() 溶液pH=6,溶液显酸性,说明
溶液pH=6,溶液显酸性,说明![]() 是弱酸,
是弱酸,![]() 是弱碱,且
是弱碱,且![]() 的电离程度小于
的电离程度小于![]() 。
。
(1)根据上述分析,![]() 是强碱,
是强碱,![]() 是弱酸,故
是弱酸,故![]() 是强碱弱酸盐,水解显碱性,pH>7;
是强碱弱酸盐,水解显碱性,pH>7;
(2)![]() 是强酸,完全电离,
是强酸,完全电离,![]() 是弱酸,不完全电离,稀释时
是弱酸,不完全电离,稀释时![]() 的电离平衡正向移动,pH变化小,故稀释相同倍数pH变化幅度:HX>HY;
的电离平衡正向移动,pH变化小,故稀释相同倍数pH变化幅度:HX>HY;![]() 是强碱,
是强碱,![]() 是弱碱,稀释相同倍数时
是弱碱,稀释相同倍数时![]() 溶液的pH变化大,故pH都下降2时,
溶液的pH变化大,故pH都下降2时,![]() 加水量少;
加水量少;
(3)在![]() 溶液中存在电荷守恒:
溶液中存在电荷守恒:![]() ,
,![]() 是强酸,故
是强酸,故![]() 未水解,浓度为1mol/L,所以
未水解,浓度为1mol/L,所以![]() ;在
;在![]() 溶液中,根据电荷守恒:
溶液中,根据电荷守恒:![]() ,故
,故![]() 。
。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目