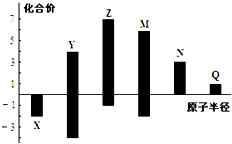
题目内容
【题目】I.0.1 mol·L-1的Na2CO3溶液中各离子浓度的关系
(1)大小关系:______________________________________________;
(2)物料守恒:______________________________________________;
(3)电荷守恒:______________________________________________;
(4)质子守恒:______________________________________________。
II.比较下列几种溶液混合后各离子浓度的大小。
(1)CH3COOH和NaOH等浓度等体积混合,离子浓度大小顺序为:___________。
(2)pH=2的CH3COOH与pH=12的NaOH等体积混合,其离子浓度大小顺序为:________________。
【答案】 c(Na+)>c(CO![]() )>c(OH-)>c(HCO)>c(H+) c(Na+)=2[c(CO
)>c(OH-)>c(HCO)>c(H+) c(Na+)=2[c(CO![]() )+c(HCO)+c(H2CO3)] c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO
)+c(HCO)+c(H2CO3)] c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO![]() ) c(OH-)=c(H+)+2c(H2CO3)+c(HCO) c(Na+)>c(CH3COO-)>c(OH-)>c(H+) c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
) c(OH-)=c(H+)+2c(H2CO3)+c(HCO) c(Na+)>c(CH3COO-)>c(OH-)>c(H+) c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【解析】I.(1)碳酸钠溶液中存在Na2CO3![]() CO32-+2Na+,CO32-+H2O
CO32-+2Na+,CO32-+H2O![]() OH-+HCO、HCO+H2O
OH-+HCO、HCO+H2O![]() H2CO3+OH-,以及H2O
H2CO3+OH-,以及H2O ![]() H++OH-,碳酸根离子的第一步的水解程度大于第二步,因此c(Na+)>c(CO32-)>c(OH-)>c(HCO)>c(H+),故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO)>c(H+);
H++OH-,碳酸根离子的第一步的水解程度大于第二步,因此c(Na+)>c(CO32-)>c(OH-)>c(HCO)>c(H+),故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO)>c(H+);
(2)碳酸钠溶液中存在物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故答案为:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);
(3)碳酸钠溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO32-),故答案为:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO32-);
(4)碳酸钠溶液中的质子守恒,可以用物料守恒互溶电荷守恒处理得到c(OH-)=c(H+)+2c(H2CO3)+c(HCO),故答案为:c(OH-)=c(H+)+2c(H2CO3)+c(HCO);
II.(1)将等体积等浓度的CH3COOH和NaOH溶液混合,反应后溶质为醋酸钠,醋酸根离子部分水解,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒可得:c(Na+)>c(CH3COO-),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)醋酸为弱电解质,pH=2的醋酸溶液中醋酸的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,两溶液混合后醋酸过量,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可得:c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。