题目内容
9.分子式为C4H9OCl,且能与钠反应产生氢气的有机物可能的同分异构体(不考虑立体异构)数目为( )| A. | 9 | B. | 10 | C. | 11 | D. | 12 |
分析 分子式为C4H9OCl,且能与钠反应产生氢气的有机物可以看做是分子式为C4H10O的有机物,分子中含有-OH,该有机物为丁醇,先书写丁基-C4H9异构,丁基异构数目等于丁醇的异构体数目,在醇分子中一个氯原子取代所得到同分异构体数目;
解答 解:分子式为C4H10O的有机物,含有-OH则一定属于饱和一元醇,丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,丁基异构数目等于丁醇的异构体数目,则丁醇的可能结构有4种,分别为:CH3CH2CH2CH2OH、CH3CH2CH(CH3)OH、(CH3)2CHCH2OH、C(CH3)3OH,被一个氯原子取代得到同分异构体为:CH3CH2CH2CH2OH存在一氯取代产物4种,CH3CH2CH(CH3)OH存在一氯取代产物4种,(CH3)2CHCH2OH存在一氯取代产物3种,C(CH3)3OH,存在一氯取代产物1种,分子式为C4H9OCl,且能与钠反应产生氢气的有机物可能的同分异构体数目12种,故选D.
点评 本题主要考查同分异构体书写、官能团的性质与确定等,题目难度中等,熟练掌握碳原子数小于5的烃基的个数是解决本题的关键,甲基与乙基均1种,丙基2种、丁基4种、戊基8种.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
19.下列关于有机物的说法不正确的是( )
| A. | 相同条件下的沸点:丙三醇>乙二醇>乙醇>乙烷>甲烷 | |
| B. | 将浸透了石蜡油的石棉放在大试管底部,大试管中加入碎瓷片,加强热,将产生的气体持续通入溴的四氯化碳溶液中,红棕色逐渐变浅,最终褪色 | |
| C. | -C3H7和-C2H5O各取代苯分子中的一个氢原子形成的二元取代物的同分异构体有24种 | |
| D. | 薄荷醇 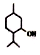 中至少有12个原子共平面 中至少有12个原子共平面 |
20.某一化学反应,在1L的密闭容器中,气态反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为( )
| A. | 3mol/(L•s) | B. | 0.3mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.1mol/(L•s) |
17.下列叙述正确的是( )
| A. | 在氧化还原反应中,一定是有一种元素被氧化,另一种元素被还原 | |
| B. | 没有单质参加或生成的反应一定不是氧化还原反应 | |
| C. | 失电子难的原子,获得电子的能力一定强 | |
| D. | 元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
4.下列叙述Ⅰ、Ⅱ正确且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 金属钠具有强还原性 | 金属钠可制作高压钠灯 |
| B | Al2O3是两性氧化物 | Al2O3可用作耐火材料 |
| C | 明矾溶于水生成Al(OH)3胶体 | 明矾可作净水剂 |
| D | Fe2O3是碱性氧化物 | Fe2O3可作红色油漆和涂料 |
| A. | A | B. | B | C. | C | D. | D |
14.下列有关物质用途的说法中,不正确的是( )
| A. | 氢氟酸可用来刻蚀玻瑞 | B. | 过氧化钠常用作供氧剂 | ||
| C. | 漂白粉可用作游泳池的消毒剂 | D. | 晶体硅可用于制作光导纤维 |
1.下列离子在溶液中可以大量共存的是( )
| A. | Na+、NO3-、SO42- | B. | Ag+、NO3-、Cl- | C. | H+、K+、CH3COO- | D. | NH4+、Na+、OH- |
2.催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO.反应的热化学方程式如下:
Ⅰ. CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 K1
Ⅱ. CO2(g)+H2(g)?CO(g)+H2O(g)△H2 K2
(1)反应Ⅰ的平衡常数表达式K1=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.若其它条件不变,升高温度,则该反应的逆反应速率增大(填“增大”、“减小”、“不变”或“无法判断”).
(2)反应Ⅱ还可以通过下列反应获得:
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3 K3
Fe(s)+H2O(g)?FeO(s)+H2(g)△H4 K4
在不同温度时K3、K4的值如下表1:
请回答(不考虑温度对△H的影响):
△H2=△H3-△H4(用△H3和△H4表示),K2=$\frac{{K}_{3}}{{K}_{4}}$ (用K3和K4表示),反应Ⅱ属于吸热反应(填“放热”或“吸热”).
(3)某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下表2实验数据:
【备注】Cat.1:$\frac{Cu}{ZnO}$纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比.
①在Cu/ZnO催化剂存在下,有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1 B.使用催化剂Cat.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
②表2中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响.
Ⅰ. CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 K1
Ⅱ. CO2(g)+H2(g)?CO(g)+H2O(g)△H2 K2
(1)反应Ⅰ的平衡常数表达式K1=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$.若其它条件不变,升高温度,则该反应的逆反应速率增大(填“增大”、“减小”、“不变”或“无法判断”).
(2)反应Ⅱ还可以通过下列反应获得:
Fe(s)+CO2(g)?FeO(s)+CO(g)△H3 K3
Fe(s)+H2O(g)?FeO(s)+H2(g)△H4 K4
在不同温度时K3、K4的值如下表1:
| 700℃ | 900℃ | |
| K3 | 1.47 | 2.15 |
| K4 | 2.38 | 1.67 |
△H2=△H3-△H4(用△H3和△H4表示),K2=$\frac{{K}_{3}}{{K}_{4}}$ (用K3和K4表示),反应Ⅱ属于吸热反应(填“放热”或“吸热”).
(3)某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下表2实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
①在Cu/ZnO催化剂存在下,有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1 B.使用催化剂Cat.2 C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
②表2中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响.
3.分子式为C5H10O的有机物,能发生银镜反应的结构有几种( )
| A. | 4种 | B. | 7种 | C. | 8种 | D. | 12种 |