题目内容
8.下列电离方程式或水解方程式中,错误的是( )| A. | Na2CO3+2H2O?H2CO3+2NaOH | B. | NH3•H20?NH4++OH- | ||
| C. | CH3COOH?H++CH3COO- | D. | Na2SO3+H2O?NaHS03+NaOH |
分析 A.碳酸根为多元弱酸根离子,分步水解;
B.NH3•H20为弱酸,存在电离平衡,用可逆符号连接,电离出铵根离子和氢氧根离子;
C.CH3COOH为弱电解质,不完全电离,电离出乙酸根离子和氢离子,用可逆符号连接;
D.亚硫酸根离子为多元弱酸根离子,分步水解,第一步水解生成亚硫酸氢根离子;
解答 解:A.碳酸根为多元弱酸根离子,以第一步水解为主,水解方程式为Na2CO3+H2O?NaHCO3+NaOH,故A错误;
B.NH3•H20为弱酸,电离出乙酸根离子和氢离子,NH3•H20?NH4++OH-,故B正确;
C.CH3COOH为弱电解质,电离出乙酸根离子和氢离子,CH3COOH?H++CH3COO-,故C正确;
D.亚硫酸根离子为多元弱酸根离子,第一步水解生成亚硫酸氢根离子Na2SO3+H2O?NaHS03+NaOH,故D正确;
故选A.
点评 本题考查了电离方程式、水解反应的离子方程式的书写,明确电解质的强弱、盐类水解的规律是解题关键,题目难度不大,注意对基础知识的积累.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
19.①丁烷;②2-甲基丙烷;③戊烷;④2-甲基丁烷;⑤2,2-二甲基丙烷.其沸点由高到低排列顺序正确的是( )
| A. | ①②③④⑤ | B. | ⑤④③②① | C. | ③④⑤①② | D. | ②①⑤④③ |
16.下列叙述中,错误的是( )
| A. | 离子化合物中可能含有非极性键 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 原子晶体中可能含有非极性键 | |
| D. | 氯化钠晶体熔化时离子键发生断裂 |
3.已知C3N4晶体具有比金刚石更大的硬度,且原子间均以单键结合.下列关于该晶体的说法不正确的是( )
| A. | C3N4晶体是原子晶体 | |
| B. | C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要短 | |
| C. | C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 | |
| D. | C3N4晶体中微粒间通过离子键结合 |
6.利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的工艺流程如下:
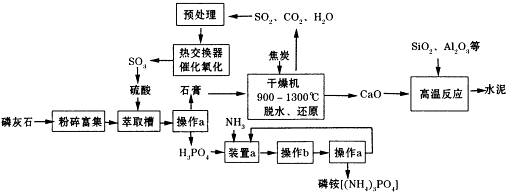
(1)D操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯
(2)在实验室中操作b包括蒸发结晶、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$ 2CaO+2SO2↑+CO2↑+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十02(g)?2S03(g).实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%).
①实际生产中,S02的催化氧化反应是在常压、400℃-500℃条件下进行.采用常压的主要原因是常压下SO2的转化率已经很高,且增大压强时SO2的转化率提高不多,但成本增加较多;该反应化学平衡常数大小关系是:K(400℃)>K(500℃)(填“>”、“<”或“=”).
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是CD.(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2CO3溶液、酚酞试液 c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸.

(1)D操作a的名称过滤,实验室中进行此操作时用到的玻璃仪器有漏斗、玻璃棒、烧杯
(2)在实验室中操作b包括蒸发结晶、冷却结晶.
(3)干燥机中发生反应的化学方程式为2CaSO4•2H2O+C$\frac{\underline{\;高温\;}}{\;}$ 2CaO+2SO2↑+CO2↑+4H2O.
(4)水泥常用做建筑材料,是利用了水泥的水硬性性质.
(5)SO2的催化氧化反应为2SO2(g)十02(g)?2S03(g).实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%).
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
②催化氧化时使用热交换器的原因是移去反应中放出的热量,使反应后的气体降温并预热未反应的气体.
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾.下列能用于测定硫酸尾气中SO2含量的试剂组是CD.(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2CO3溶液、酚酞试液 c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸.

 、
、 .
. 某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:
某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验: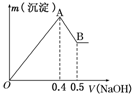 现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )
现有AlCl3和MgSO4的混合溶液,向其中不断加入NaOH溶液得到的沉淀的量与加入NaOH溶液的体积关系如图所示,则原溶液中Cl-、SO42-的物质的量之比为( )