题目内容
【题目】研究煤的合理利用及CO2的综合应用有着重要的意义。请回答以下问题:
Ⅰ.煤的气化
已知煤的气化过程涉及的基本化学反应有:
①C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131 kJ/mol
CO(g)+H2(g) ΔH=+131 kJ/mol
②CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH=a kJ/mol
CH4(g)+H2O(g) ΔH=a kJ/mol
查阅资料反应②中相关化学键键能数据如下表:
化学键 | C≡O | H-H | H-C | H-O |
E/(kJ/mol) | 1072 | 436 | 414 | 465 |
(1)则反应②中a=______。
(2)煤直接甲烷化反应C(s)+2H2 (g)![]() CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
CH4(g)的ΔH为______kJ/mol,该反应在______(填“高温”或“低温”)下自发进行。
Ⅱ.合成低碳烯烃
在体积为1 L的密闭容器中,充入1 mol CO2和2.5 mol H2,发生反应: 2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
C2H4(g)+4H2O(g) ΔH=-128 kJ/mol,测得温度对催化剂催化效率和CO2平衡转化率的影响如右图所示:
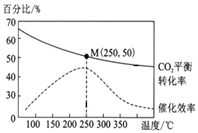
(3)图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是______。
(4)250℃时,该反应的平衡常数K值为______。
Ⅲ.合成甲醇
在恒温2 L容积不变的密闭容器中,充入1 molCO2和3 molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
CH3OH(g) +H2O(g) ,测得不同时刻反应前后容器内压强变化(p后/p前)如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
p后/p前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
(5)反应前1小时内的平均反应速率v(H2)为______mol/(L·h),该温度下CO2的平衡转化率为______。
Ⅳ.电解逆转化制乙醇
(6)科研人员通过反复实验发现:CO2可以在酸性水溶液中电解生成乙醇,则生成乙醇的反应发生在______极(填“阴”或“阳”),该电极的反应式为______。
【答案】-206 -75 低温 该反应ΔH<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低 1 0.3 40% 阴 2CO2+12H++12e-=CH3CH2OH+3H2O
【解析】
(1)根据反应热等于旧键断裂吸收的能量与新键形成释放的能量的差值计算;
(2)根据盖斯定律分析解答;反应若自发进行,则△G=ΔH-TΔS<0;
(3)根据温度对催化剂的催化活性和对化学平衡移动影响分析CO2转化率的变化;
(4)利用化学平衡常数定义式计算;
(5)根据在恒容密闭容器内,气体的压强比等于气体的物质的量的比,计算出H2物质的量的改变值,再根据速率的定义计算;同时利用变化关系计算出平衡时CO2改变的物质的量,利用物质的转化率为质量除以起始量,计算出该温度下CO2的平衡转化率;
(6)根据阳极发生氧化反应,阴极发生还原反应,结合溶液的酸碱性书写电极反应式。
(1)根据反应方程式CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH=a kJ/mol,可知ΔH=(1072+3×436-4×414-2×465)kJ/mol=-206kJ/mol;
CH4(g)+H2O(g) ΔH=a kJ/mol,可知ΔH=(1072+3×436-4×414-2×465)kJ/mol=-206kJ/mol;
(2)①+②,整理可得:C(s)+2H2 (g)![]() CH4(g)的ΔH=+131 kJ/mol-206kJ/mol=-75kJ/mol;该反应是气体体积减小的放热反应,根据体系的自由能公式△G=ΔH-TΔS,若反应自发进行,则△G=ΔH-TΔS<0,所以温度较低时△G<0,反应自发进行;
CH4(g)的ΔH=+131 kJ/mol-206kJ/mol=-75kJ/mol;该反应是气体体积减小的放热反应,根据体系的自由能公式△G=ΔH-TΔS,若反应自发进行,则△G=ΔH-TΔS<0,所以温度较低时△G<0,反应自发进行;
(3)由图分析可知在250℃时催化剂活性最大,在低于该温度时,升高温度,催化剂活性增强;而CO2的平衡转化率却随温度的升高反而降低,是由于该反应的正反应为放热反应,升高温度,化学平衡向吸热的逆反应方向移动,使反应物CO2转化率降低;
(4)在250℃时CO2转化率为50%,根据起始时加入的物质的物质的量及反应2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)中各种物质的转化关系可知,达到平衡时各种物质的平衡浓度分别为c(CO2)=0.5mol/L;c(H2)=1.0mol/L;c(C2H4)=0.25mol/L;c(H2O)=1.0mol/L,则该温度下的化学平衡常数K=
C2H4(g)+4H2O(g)中各种物质的转化关系可知,达到平衡时各种物质的平衡浓度分别为c(CO2)=0.5mol/L;c(H2)=1.0mol/L;c(C2H4)=0.25mol/L;c(H2O)=1.0mol/L,则该温度下的化学平衡常数K=![]() ;
;
(5)化学反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
n(开始)/mol 1 3 0 0
1h△n/mol x 3x x x
△n(平衡)/mol y 3y y y
在1h时气体的总物质的量n=(1-x)+(3-3x)+x+x=(4-2x)mol,开始时总物质的量为4mol,根据![]() ,解得x=0.2mol,所以H2改变的物质的量为3×0.2mol=0.6mol, v(H2)=
,解得x=0.2mol,所以H2改变的物质的量为3×0.2mol=0.6mol, v(H2)=![]() mol/(Lh);
mol/(Lh);
在平衡时气体的总物质的量n=(1-y)+(3-3y)+y+y=(4-2y)mol,开始时总物质的量为4mol,根据![]() ,解得y=0.4mol,所以CO的平衡转化率=(0.4mol÷1mol)×100%=40%;
,解得y=0.4mol,所以CO的平衡转化率=(0.4mol÷1mol)×100%=40%;
(6)CO2中的C化合价为+4价,乙醇CH3CH3OH中C的平均化合价为-2价,化合价降低,获得电子,所以生成乙醇的反应发生在阴极,在酸性条件下,CO2在阴极获得电子,变为乙醇,电极反应式为:2CO2+12H++12e-=CH3CH2OH+3H2O。