题目内容
17.下列四种元素中,其单质氧化性最强的是( )| A. | 原子中2p能级比2s能级多一个电子的第二周期元素 | |
| B. | 位于元素周期表中第三周期ⅢA族的元素 | |
| C. | 原子最外层电子排布为2s22p6的元素 | |
| D. | 原子最外层电子排布为2s22p5的元素 |
分析 根据原子结构判断各选项中元素,根据结构特点与非金属性判断,非金属性越强,单质的氧化性越强.
解答 解:A.原子含未成对电子最多的第二周期元素是N元素,氮气分子中含有三键,氮气的化学性质稳定;
B.位于元素周期表中第三周期ⅢA族的元素,属于铝元素;
C.基态原子最外层电子排布为2s22p6的元素是Ne元素,最外层电子数为8,化学性质稳定;
D.原子最外层电子排布为3s23p5的元素是F元素,
非金属性F>N,F2的氧化性最强,
故选D.
点评 本题考查结构位置以性质关系,为高频考点,侧重考查学生的分析能力,比较基础,注意基础知识的掌握,注意把握单质氧化性的判断方法.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
7.下列有关说法正确的是( )
| A. | 臭氧被称为绿色氧化剂,无毒无害 | |
| B. | 王水是浓盐酸和浓硝酸按体积比1:3配成的混合物,可以溶解Au、Pt | |
| C. | 氨水能导电,说明氨气是电解质 | |
| D. | 新制备的氯水中存在3种分子、4种离子 |
5.实验室不需要用棕色试剂瓶保存的试剂是( )
| A. | 浓硝酸 | B. | 硝酸银 | C. | 氯水 | D. | 氨水 |
12.根据能量变化示意图得幽的结论正确的是( )
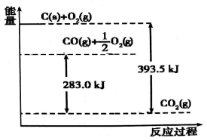

| A. | 1mol C完全燃烧生成CO2时放出的热量为393.5 kJ/mol | |
| B. | 2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol | |
| C. | 2CO2 (g)═2CO(g)+O2(g)△H=+283.0 kJ/mol | |
| D. | C(s)+O2(g)═CO2 (g)△H=+393.5 kJ/mol |
2.下列元素属于ds区的是( )
| A. | Ca | B. | Fe | C. | Cu | D. | P |
9.下列离子方程式的书写不正确的是( )
| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液和盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | CaCO3跟稀硫酸反应:CaCO3+H++SO42-═CaSO4+H2O+CO2↑ | |
| D. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O |