题目内容
【题目】(1)按要求填空
①4.8gO3和0.2molCH4,在同温同压下的体积之比是____。②同温同压下,NH3和H2S气体的密度比是___;③同温同体积下,同质量的NH3和H2S气体的压强之比是___。
(2)写出下列物质在水中的电离方程式:
NaHSO4:___
H2SO4:___
NaHCO3:___
【答案】1:2 1:2 2:1 NaHSO4=Na++H++SO42- H2SO4=2H++SO42- NaHCO3=Na++HCO3-
【解析】
(1) ①同温同压下,气体的体积之比等于物质的量之比;4.8gO3的物质的量为![]() =0.1mol,则同温同压下的体积之比是0.1mol:0.2mol=1:2;
=0.1mol,则同温同压下的体积之比是0.1mol:0.2mol=1:2;
②同温同压下,气体的密度之比等于摩尔质量之比,NH3和H2S的摩尔质量分别为17g/mol和34g/mol,则密度比是17:34=1:2;
③同温同体积下,压强之比等于物质的量之比;根据![]() ,同质量的NH3和H2S气体的物质的量之比与摩尔质量成反比,同质量的NH3和H2S气体的物质的量之比为34:17=2:1,则同温同体积下,同质量的NH3和H2S气体的压强之比是2:1;
,同质量的NH3和H2S气体的物质的量之比与摩尔质量成反比,同质量的NH3和H2S气体的物质的量之比为34:17=2:1,则同温同体积下,同质量的NH3和H2S气体的压强之比是2:1;
(2)硫酸氢钠是强电解质,在水溶液里完全电离生成钠离子、氢离子和硫酸根离子,电离方程式为![]() ;
;![]() 是二元强酸,完全电离,电离方程式为
是二元强酸,完全电离,电离方程式为![]()
![]() ;碳酸氢钠是强电解质,在水溶液里完全电离生成钠离子、碳酸氢根离子,电离方程式为
;碳酸氢钠是强电解质,在水溶液里完全电离生成钠离子、碳酸氢根离子,电离方程式为![]() ,故答案为:
,故答案为:![]() ;
;![]()
![]() ;
;![]() 。
。

【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) ![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 | 2molSO2、1molO2 |
平衡v正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率a | α1 (SO2) | α2 (SO3) | α3 (SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A. v/span>1<v2,c2< 2c1 B. K1>K3,p2> 2p3
C. v1<v3,α1(SO2) <α3(SO2) D. c2> 2c3,α2(SO3)+α3(SO2)<1
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如下:
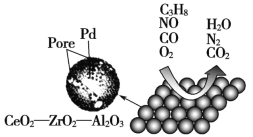
(1)Zr原子序数为40,价电子排布式为4d25s2,它在周期表中的位置是_______________。
(2)图中互为等电子体的两种气体分子是_____________。
(3)C3H8中所有碳原子的杂化方式是___________。
(4)图中属于非极性的气体分子是_______________________。
Fe、Mn元素的部分电离能数据列于下表中
元素 | Fe | Mn | |
电离能(kJ·mol-1) | I1 | 759 | 717 |
I2 | 1561 | 1509 | |
I3 | 2957 | 3248 | |
(5)从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是_____________。
(6)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为_____________,[Ni(CO)4]的配体是_________,配位原子是__________。
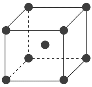
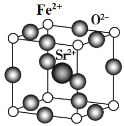
(7)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有______个。
(8)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为______________g·cm-3(用来a、b、NA表示计算结果)。