题目内容
【题目】汽车尾气中含有CO、NO、NO2等多种污染物。
(1)在汽车的排气管上装一个催化转换装置,能使CO和NO反应生成无污染的气体,写出该反应的化学方程式_____
(2)研究表明:增大催化剂(相同质量下比较)比表面积可提高化学反应速率,为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | CO 初始浓度/mol·L-1 | NO 初始浓度/mol·L-1 | 催化剂的比表面积/m·g-1 |
Ⅰ | 300 | 4.5×10-3 | 1.5×10-3 | 100 |
Ⅱ | ______ | 4.5×10-3 | 1.5×10-3 | 200 |
Ⅲ | 500 | 4.5×10-3 | _________ | 200 |
请在上表格中填入剩余的实验条件数据,三组实验中的反应速率由快到慢的顺序为 ______(填实验编号)
(3)大众"检测门"事件让"尿素可用于汽车尾气脱氮”又科普了一把,其反应原理为:NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O
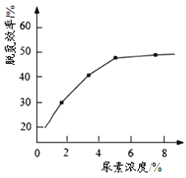
① 图为尿素含量对脱氮效率的影响,一般选择尿素浓度约5%左右,其原因是_______
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=3:1时,可通入一定量的空气,同温同压下,V(空气):V(NO2)=_____(空气中氧气的体积含量大约为 20%)
【答案】2CO+2NO ![]() 2CO2+N2 300 1.5×10-3 Ⅲ>Ⅱ>Ⅰ 浓度大于 5%后,脱氮效率不再明显提高,选择 5%的浓度,可以在保证脱氮效率的前提下节 约生产成本 5:2
2CO2+N2 300 1.5×10-3 Ⅲ>Ⅱ>Ⅰ 浓度大于 5%后,脱氮效率不再明显提高,选择 5%的浓度,可以在保证脱氮效率的前提下节 约生产成本 5:2
【解析】
(1)汽车尾气催化转换装置,能使CO和NO反应生成N2和CO2,由此可写出该反应的化学方程式。
(2)实验的目的是研究温度、催化剂比表面积对化学反应速率的影响规律,若研究温度对化学反应速率的影响规律,则只有温度变化,其它数据不变;当研究催化剂比表面积对化学反应速率的影响规律,则只有催化剂的比表面积改变,其它数据不变,由此可得出结论。
比较三组实验中的反应速率由快到慢的顺序时,温度越高,反应速率越快;催化剂的比表面积越大,反应速率越快。
(3)①分析选择尿素浓度约5%左右时,借助图中信息,从尿素浓度为5%、大于5%两个方面,分析对脱氮效率、成本的影响,从而找出原因。
②从反应方程式看,V(NO):V(NO2)=1:1时,汽车尾气脱氮效果最好,由此可利用反应2NO+O2==2NO2,计算所需O2与NO2的体积关系,从而求出同温同压下,V(空气):V(NO2)。
(1)汽车尾气催化转换装置,能使CO和NO反应生成N2和CO2,反应的化学方程式为2NO+2CO![]() N2+2CO2。答案为:2NO+2CO
N2+2CO2。答案为:2NO+2CO![]() N2+2CO2;
N2+2CO2;
(2)从表中可以看出,Ⅰ、Ⅱ两组实验中,催化剂的比表面积不同,则其它数据应相同,由此得出实验Ⅱ的温度应为300℃;Ⅱ、Ⅲ两组实验相比,温度不同,则NO的浓度应相同,应为1.5×10-3mol/L;实验Ⅱ的催化剂的比表面积大于实验Ⅰ,则反应速率Ⅱ>Ⅰ,实验Ⅲ的温度高于实验Ⅱ,则反应速率Ⅲ>Ⅱ,所以Ⅲ>Ⅱ>Ⅰ。答案为:300;1.5×10-3;Ⅲ>Ⅱ>Ⅰ;
(3)①图中信息显示,尿素浓度为5%时,脱氮效率基本达到最高点,且增大尿素浓度,虽然脱氮效率有所增大,但增大幅度很少,且会提高脱氮成本,所以选择5%,其原因是浓度大于5%后,脱氮效率不再明显提高,选择5%的浓度,可以在保证脱氮效率的前提下节约生产成本。答案为:浓度大于5%后,脱氮效率不再明显提高,选择5%的浓度,可以在保证脱氮效率的前提下节约生产成本;
②从反应方程式看,V(NO):V(NO2)=1:1时,汽车尾气脱氮效果最好。若烟气中V(NO):V(NO2)=3:1时,通入空气发生反应2NO+O2==2NO2,则所需O2与NO2的体积关系为1:2,从而求出同温同压下,V(空气):V(NO2)=![]() :2=5:2。答案为:5:2。
:2=5:2。答案为:5:2。

 名校课堂系列答案
名校课堂系列答案【题目】肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | a | b | c |
工业上合成氨的反应 N2(g)+3H2(g) 2NH3(g) ΔH=_____kJ·mol-1.
(2)肼—空气燃料电池是一种环保型燃料电池,结构如图 1 所示
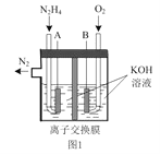
①肼—空气燃料电池的负极反应式为_____
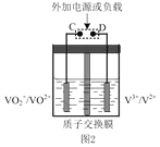
②全钒液流可充电电池结构如图 2 所示,将肼—空气燃料电池的 A 极与全钒液流可充电电池的 C 极相连,B 极与 D 极相连,写出阴极的电极反应____
(3)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,与使用 Na2SO3 处理水中溶解的 O2 相比,肼的优点是_____
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D