题目内容
【化学与技术】请回答氯碱工业的有关问题:
(1)以前采用无隔膜电解冷的食盐水时,Cl2会与NaOH接触,产物中肯定有NaClO,从而影响产品的纯度,能包含这一过程的总化学方程式为
(2)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.
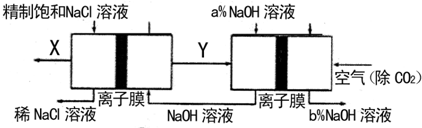
分析比较图示中氢氧化钠质量分数a%与b%的大小:a%
理由是:
(3)科研人员为减少火力发电厂对环境的污染,曾经考虑让火力发电厂和氯碱制造厂进行就近联合.请你判断该方案是否可行?
A.发电厂的废气(SO2)与氯碱厂的Cl2或NaOH反应,减少了SO2的排放
B.可产生多种化学原料
C.就近联合还能减少电力输送中的损耗
(4)将酸碱中和反应作为电池反应,可以设计出相应的电池.现将两个氢电极(以Pt 作为导电的惰性金属,以氢气作为参与电极反应的物质,可以是生成氢气,也可以是消耗氢气)分别置于酸性水溶液( H+)和碱性水溶液(OH-)中构成电池,使电池反应为酸碱中和反应.
①酸溶液中的氢电极A 和碱溶液中的氢电极B,为电池正极是
②B极上发生的电极反应为:
分析:(1)根据电解氯化钠溶液的生成物有氯气、氢气和氢氧化钠,然后Cl2和NaOH,产物是NaClO和氯化钠和水来书写总方程式;根据电解食盐水,与正极相连为阳极,氯离子放电,生成氯气,与电源负极相连为阴极,氢离子放电,生成氢气和NaOH;
(2)燃料电池通入的Y应为H2,则电解池生成的X为Cl2,结合原电池和电解池的工作原理解答;
(3)将发电厂产生的废气(SO2)与氯碱厂的Cl2或NaOH反应,减少了SO2的排放,又可产生多种化学原料;
(4)根据原电池原理和题目信息可知,酸性溶液中氢离子得到电子形成氢气,为正极,碱性溶液中,氢气失去电子变成氢离子,为负极.
(2)燃料电池通入的Y应为H2,则电解池生成的X为Cl2,结合原电池和电解池的工作原理解答;
(3)将发电厂产生的废气(SO2)与氯碱厂的Cl2或NaOH反应,减少了SO2的排放,又可产生多种化学原料;
(4)根据原电池原理和题目信息可知,酸性溶液中氢离子得到电子形成氢气,为正极,碱性溶液中,氢气失去电子变成氢离子,为负极.
解答:解:(1)电解氯化钠溶液的生成物有氯气、氢气和氢氧化钠,方程式为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,Cl2和NaOH,产物是NaClO和氯化钠和水,方程式为:2NaOH+Cl2═NaClO+NaCl+H2O,两式相加,能包含这一过程的总化学方程式为:NaCl+H2O
H2↑+NaClO;电解食盐水,与正极相连为阳极,氯离子放电,生成氯气,与电源负极相连为阴极,氢离子放电,生成氢气和NaOH,则从阴极区排出的是氢气和NaOH,
故答案为:NaCl+H2O
H2↑+NaClO;氢气和NaOH;
(2)在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%大于b%,
故答案为:>;氢氧燃料电池最后产生的是水,溶液稀释;
(3)发电厂产生的废气(SO2)与氯碱厂的Cl2或NaOH反应:2NaOH+SO2=Na2SO3+H2O,SO2+Cl2+2H2O=H2SO4+2HCl;减少了SO2的排放,又可产生多种化学原料,如H2SO4、HCl等,
故答案为:可行;AB;
(4)由原电池原理和题目信息可知,酸性溶液中氢离子得到电子形成氢气,为正极,电极反应为:2H++2e-=H2↑;碱性溶液中,氢气失去电子变成氢离子,为负极,电极反应为:H2+2OH--2e-=2H2O,
故答案为:①A;②H2+2OH--2e-=2H2O.
| ||
| ||
故答案为:NaCl+H2O
| ||
(2)在燃料电池中,氧气作正极,所以通入空气的极是正极,通入燃料的极是负极,即产生Y的极是阴极,所产生的是氢气,在X处产生的是氯气,氢氧燃料电池最后产生的是水,所以a%大于b%,
故答案为:>;氢氧燃料电池最后产生的是水,溶液稀释;
(3)发电厂产生的废气(SO2)与氯碱厂的Cl2或NaOH反应:2NaOH+SO2=Na2SO3+H2O,SO2+Cl2+2H2O=H2SO4+2HCl;减少了SO2的排放,又可产生多种化学原料,如H2SO4、HCl等,
故答案为:可行;AB;
(4)由原电池原理和题目信息可知,酸性溶液中氢离子得到电子形成氢气,为正极,电极反应为:2H++2e-=H2↑;碱性溶液中,氢气失去电子变成氢离子,为负极,电极反应为:H2+2OH--2e-=2H2O,
故答案为:①A;②H2+2OH--2e-=2H2O.
点评:本题及元素化合物的推断、化合物的性质、电化学等问题,题目具有较大难度,做题时注意把握推断的思路和电解原理是解题的关键.

练习册系列答案
相关题目
 请回答氯碱工业的如下问题:
请回答氯碱工业的如下问题:

 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);