题目内容
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1mol NaHSO4晶体中离子总数为3NA |
| B、5.6g铁粉与硝酸反应失去的电子数一定为0.3NA |
| C、0.1L 3mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| D、标况下,将FeSO4溶液置于空气中,被氧化的Fe2+为0.2NA,吸收O2为1.12L |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、硫酸氢钠是钠离子和磷酸氢根离子构成分析;
B、依据n=
计算铁物质的量,铁和硝酸反应可以生成亚铁离子或铁离子;
C、铵根离子水解;
D、依据硫酸亚铁被氧气氧化为硫酸铁的定量关系计算需要的氧气;
B、依据n=
| m |
| M |
C、铵根离子水解;
D、依据硫酸亚铁被氧气氧化为硫酸铁的定量关系计算需要的氧气;
解答:
解:A、硫酸氢钠是钠离子和磷酸氢根离子构成分析,1mol NaHSO4晶体中离子总数为2NA,故A错误;
B、依据n=
计算铁物质的量=
=0.1mol,铁和硝酸反应可以生成亚铁离子或铁离子,反应失去的电子数可能为0.3NA,或0.2NA,故B错误;
C、铵根离子水解,0.1L 3mol?L-1的NH4NO3溶液中含有的NH4+数目小于0.3NA,故C错误;
D、依据硫酸亚铁被氧气氧化为硫酸铁的定量关系计算需要的氧气,标况下,将FeSO4溶液置于空气中被氧化,氧化还原反应电子守恒,4Fe2+~4Fe3+~O2~4e-,被氧化的Fe2+为0.2NA,吸收O2物质的量为0.05mol,标准状况体积=0.05mol×22.4L/mol=1.12L,故D正确;
故选D.
B、依据n=
| m |
| M |
| 5.6g |
| 56g/mol |
C、铵根离子水解,0.1L 3mol?L-1的NH4NO3溶液中含有的NH4+数目小于0.3NA,故C错误;
D、依据硫酸亚铁被氧气氧化为硫酸铁的定量关系计算需要的氧气,标况下,将FeSO4溶液置于空气中被氧化,氧化还原反应电子守恒,4Fe2+~4Fe3+~O2~4e-,被氧化的Fe2+为0.2NA,吸收O2物质的量为0.05mol,标准状况体积=0.05mol×22.4L/mol=1.12L,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,氧化还原反应电子转移分析,盐类水解的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
核磁共振(NMR)技术已广泛应用于复杂分子结构测定和医学诊断等高科技领域.已知只有质子数和中子数均为奇数的原子核有NMR现象.试判断下列原子均可产生NMR现象的是( )
| A、18O 31P 119 Sn |
| B、27Al 19 F 12C |
| C、80Br 2H 14N |
| D、元素周期表中第一周期所有元素的原子 |
下列化学微粒可以代表一个分子的是( )
A、 |
B、 |
| C、64Cu |
D、 |
苏丹红是很多国家禁止用于食品生产的合成色素,结构简式如图所示,关于苏丹红的说法错误的是( )
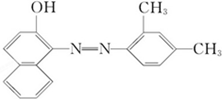

| A、分子中含有三个苯环 |
| B、属于芳香烃 |
| C、1mol该有机物中含有18mol的碳原子 |
| D、含有烃基属于酚类 |
下列现象或事实可以用同一原理解释的是( )
| A、将少量品红溶液分别滴入浓硝酸中和氯水中 |
| B、漂白粉及水玻璃长期暴露于空气中而变质 |
| C、酸性高锰酸钾溶液与亚硫酸钠溶液混合后褪色及硫酸铁溶液与淀粉碘化钾溶液混合后变蓝 |
| D、将适量Na2O2和Na分别加入硫酸亚铁溶液中;都能得到红褐色沉淀 |
下列变化是化学变化的是( )
| A、石油蒸馏 | B、煤干馏 |
| C、干冰升华 | D、分液 |
下列物质分子的电子式正确的是( )
A、CH3Cl |
B、羟基  |
C、CO2  |
D、C2H4 |
 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( ) 某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.