题目内容
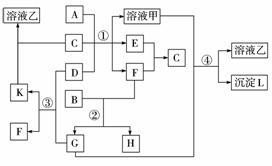
下图中A—H均由短周期元素组成(部分产物已略去),H是生活中的常用物质,也是化工生产的重要原料。
请回答:
(1)H的化学式为_________________。
(2)若A是一种常见酸性氧化物,且可用于制玻璃。写出A和碳反应制半导体材料的化学方程式:_______________________。
(3)若A是第三周期某金属元素的单质,当F的水溶液过量时,G为可溶性盐;当F的水溶液不足时,G为沉淀。写出E与少量F的水溶液反应的离子方程式:_________________。
(4)若A是一种常用化肥的主要成分,E与F反应有白烟产生。E分子的结构呈____________形。若在标准状况下,用体积为V L的烧瓶收集满F后做喷泉实验,假设溶液充满烧瓶且溶质不扩散,则该溶液中溶质的物质的量浓度为__________________。(保留三位小数)
解析:本题突破口是抓住物质H的三个关键信息:一是生活中的常用物质;二是化工生产的重要原料;三是H溶液电解时能得到三种产物。综合以上信息可知H为NaCl。
(2)制造玻璃的原料为SiO2、Na2CO3和CaCO3。A可用于制玻璃,是常见酸性氧化物,则A为SiO2。由SiO2和C反应可以制取半导体材料Si。
(3)结合图表信息可知,F为HCl。A是第三周期金属单质,且A能与NaOH反应,可知A为Al。Al与NaOH反应生成NaAlO2。当盐酸过量时,G为AlCl3,盐酸不足时,G为Al(OH)3。
(4)E与HCl气体反应生成白烟,则E为NH3,其空间构型为三角锥形。
喷泉实验后溶液充满烧瓶,且溶质不扩散,烧瓶中所得溶液溶质的物质的量浓度为:(V L/
答案:(1)NaCl
(2)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(3)![]() +H++H2O
+H++H2O![]() Al(OH)3↓
Al(OH)3↓
(4)三角锥 0.045 mol·L-1