��Ŀ����
�ס�����ͬѧΪ̽��SO2������Ա���ǿ�����ܷ�Ӧ���ɰ�ɫBaSO3����������ͼ��ʾװ�ý���ʵ��(�г�װ�ú�A�м�ִװ�����ԣ��������Ѽ���)

ʵ�����������

(1)A�з�Ӧ�Ļ�ѧ����ʽ��________��
(2)C�а�ɫ������________��
(3)C��Һ���Ϸ����ɺ���ɫ����Ļ�ѧ����ʽ��________��
(4)����B�в�����ϡ����ij���������ԭ��ͬѧ��Ϊ�ǿ����е��������뷴Ӧ����ͬѧ��Ϊ�ǰ���(��������)���뷴Ӧ��
��Ϊ֤ʵ���ԵĹ۵㣬��ԭʵ������ϣ�
��ͬѧ��ԭ�в���֮ǰͨN2һ��ʱ�䣬Ŀ����________����ͬѧ��A��B������ʢ�б���NaHSO3��Һ��ϴ��ƿD��D�з�Ӧ�����ӷ���ʽ��________��
�ڸ��Խ���ʵ�飬B������
![]()
�����ӷ���ʽ������ͬѧ�۲쵽��ʵ������________(������ƽ)��
(5)����(4)����ͬѧ�ķ��������������飬����B���������ɣ���C�в�����ɫ�������ɴ˵ó��Ľ�����________��
������
|
����(1)2H2SO4(Ũ)��Cu ����(2)BaSO4(1��) ����(3)2NO��O2��2NO2(2��) ����(4)���ų�װ���еĿ����ĸ���(2��)��H+��HSO ������2Ba2+��2SO2��O2��2H2O ����(5)SO2������Ա���ǿ���β��ܷ�Ӧ����BaSO3����(2�֣�����������Ҳ�ɸ���) |

������ʯ����Ҫ�ɷ�ΪFeS2������FeS���������������в���Fe��SԪ�أ��Ҹ����²�������ѧ�仯�������ҹ���������᳧��ȡ�������Ҫԭ�ϣ�ij��ѧ��ȤС��Ըû�����ʯ��������ʵ��̽����
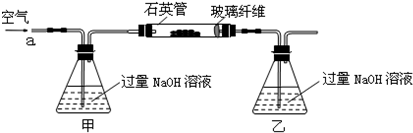
��m1g�û�����ʯ����Ʒ��������ͼװ�ã��гֺͼ���װ���ԣ���ʯӢ���У���a�����ϵػ���ͨ��������������ջ�������Ʒ����Ӧ��ȫ���䷴Ӧ�Ļ�ѧ����ʽΪ��
4FeS2+11O2 2Fe2O3+8SO2����
2Fe2O3+8SO2����
4FeS+7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
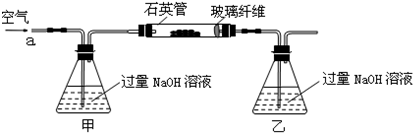
ʵ��һ���ⶨ��Ԫ�صĺ���
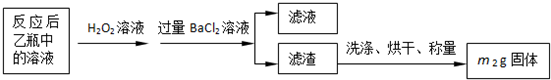
��Ӧ��������ƿ�е���Һ�������´�����
��1���ס�����װ�õ����÷ֱ���______��______��
��ƿ�ڷ�����Ӧ�����ӷ���ʽΪ______��______��
��2����Ӧ����ƿ�е���Һ�������H2O2��Һ��Ŀ����______��
��3���û�����ʯ����Ԫ�ص���������Ϊ______��
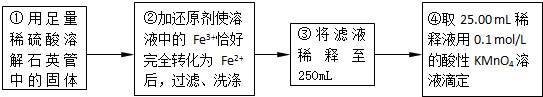
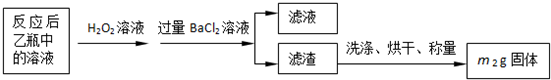
ʵ������ⶨ��Ԫ�صĺ���
��4�����У�������������ԭ����������õ���Ԫ�صĺ���______���ƫ����ƫС������Ӱ�족����
��5�����У���Ҫ�õ����������ձ�������������ͷ�ι��⣬����______��
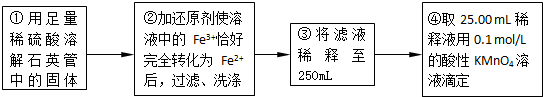
��6��ijͬѧһ�����������εζ�ʵ�飬����ʵ������¼���£�
| ʵ����� | ��һ�� | �ڶ��� | ������ |
| ����KMnO4��Һ���/mL | 25.00 | 25.03 | 24.97 |
| ʵ���� | ʵ���¶�/�� | c��Na2S2O3��/mol?L-1 | c��H2SO4��/mol?L-1 |
| �� | 25 | 0.1 | 0.1 |
| �� | 25 | 0.1 | 0.2 |
| �� | 50 | 0.2 | 0.1 |
| �� | 50 | 0.1 | 0.1 |
̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬Ӧѡ��______����ʵ���ţ���
��2����֪Na2S2O3��Һ��Cl2��Ӧʱ��1mol Na2S2O3ת��8mol���ӣ��÷�Ӧ�����ӷ���ʽ��______��
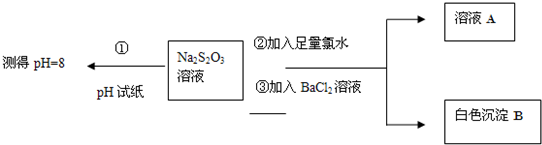
��ͬѧ�������ʵ������̽��Na2S2O3�Ļ�ѧ���ʣ�
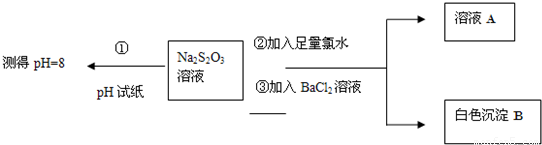
����ͬѧ���ʵ�����̵�Ŀ����֤��Na2S2O3��Һ���м��Ժ�______�ԣ�
�������ɰ�ɫ����B�����ӷ���ʽ��______��
������ͬѧ��ΪӦ�����������Тڢ������Լ�˳��ߵ�������Ϊ�ס�����ͬѧ����Ƹ���������______����ס����ҡ�����������______��