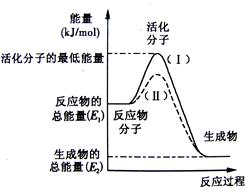
题目内容
下列关于反应过程中能量变化的说法正确的是
| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
D
解析试题分析:A、使用催化剂,降低反应的活化能,图中反应物能量比生成物能量低,反应为吸热反应,ΔH>0,错误; B、等物质的量炭完全燃烧比不完全燃烧放热多,︱ΔH1︱>︱ΔH2︱错误;C、ΔH为生成物能量与反应物能量之差,与反应条件无关,错误;D、ΔH=反应物总能量-生成物总能量=正反应活化能-逆反应活化能,正确。
考点: 化学反应与能量 活化能

练习册系列答案
相关题目
已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
| A.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g) ?H=-48.40kJ/mol |
| B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=-5518kJ/mol |
| C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=+5518kJ/mol |
| D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ?H=-48.40kJ/mol |
已知2H2(g)+O2(g)→2H2O(g)+483.6kJ。下列说法或表达正确的是
| A.在相同的条件下,2mol 氢气与 1 mol 氧气的总能量小于2mol 水蒸气的总能量 |
| B.H2(g)+1/2 O2(g)→H2O(1)+Q1;Q1>241.8kJ |
| C.H2(g)+ 1/2O2(g)→H2O(1)+Q2;Q2<241.8kJ |
| D.任何条件下,2L水蒸气分解成2L氢气与1L氧气需吸收483.6kJ热量 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3一kJ/mol、2800 kJ/mol。则下列热化学方程式正确的是
A.C(s)+ O2(g)=CO(g);△H=" -" 393.5 kJ/mol O2(g)=CO(g);△H=" -" 393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l);△H="+571.6" kJ/mol |
| C.CH4(g)+CO2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H="-1400" kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H="-1400" kJ/mol |
下列叙述不正确的是
| A.纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B.氢氧燃料电池是一种将化学能转化为电能的装置 |
| C.可用浸有酸性高锰酸钾溶液的滤纸来检验二氧化硫气体的漂白性 |
| D.塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解 |
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,下列叙述正确的是( )
| A.2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ |
| B.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),吸收热量571.6 kJ |
| C.2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ |
| D.2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
下列说法中正确的是
| A.化学反应中的能量变化,表现形式除热量外还可以是光能和电能等 |
| B.化学反应中的能量变化不一定服从能量守恒定律 |
| C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同 |
| D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
下列对化学反应的认识错误的是
| A.会引起化学键的变化 | B.会产生新的物质 |
| C.必然引起物质状态的变化 | D.必然伴随着能量的变化 |