题目内容
【题目】某化学学习小组用某种粗盐进行提纯实验,步骤如图所示:已知粗盐中含有的杂质离子主要为:Mg2+、Ca2+、Fe3+、SO42-。
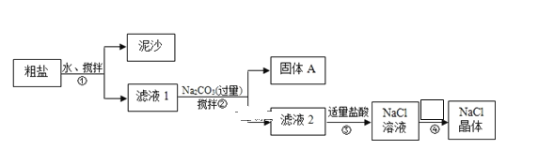
(1)步骤①和②的操作名称是___,所需要玻璃仪器为___。
(2)步骤②中在加入Na2CO3溶液之前还需加入过量NaOH溶液和BaCl2溶液,固体A是:___、___、Fe(OH)3 、BaSO4、BaCO3 (用化学式表示)
(3)步骤②中检验SO42-沉淀完全的操作是:___;
(4)步骤③中加入盐酸的作用是(用离子方程式表示)___;
(5)步骤④的操作为:___、过滤。
【答案】过滤 漏斗、烧杯、玻璃棒 Mg(OH)2 CaCO3 取少量滤液2,加入盐酸酸化,再滴加少量BaCl2溶液,若无沉淀生成,则说明已沉淀完全 CO32-+2H+=CO2↑+H2O、H++OH-=H2O 蒸发结晶
【解析】
步骤①是过滤,除掉泥沙等难溶性杂质,再加入过量NaOH溶液、BaCl2溶液、Na2CO3除掉Mg2+、Ca2+、Fe3+、SO42-等杂质,过滤,经过步骤③后得NaCl溶液,可以通过蒸发浓缩、过滤的方法,得到NaCl晶体。
:(1)从框图可知,步骤①和②均实现了固液分离,故操作均为过滤;过滤用到的玻璃仪器有漏斗、烧杯、玻璃棒;故答案为:过滤;漏斗、烧杯、玻璃棒;
(2)粗盐提纯用到三种除杂试剂:NaOH溶液、BaCl2溶液和Na2CO3溶液,加入过量NaOH溶液,能将Mg2+、Fe3+沉淀为Mg(OH)2、Fe(OH)3,发生反应:Mg2++2OH-=Mg(OH)2↓ Fe3++3OH-=Fe(OH)3↓,加入过量的BaCl2溶液,能将SO42-沉淀为BaSO4,加入Na2CO3溶液能将Ca2+、Ba2+沉淀为CaCO3、BaCO3,故得到的沉淀有:Mg(OH)2、CaCO3、Fe(OH)3 、BaSO4 、BaCO3;故答案为:Mg(OH)2、CaCO3;
(3)如果SO42-沉淀完全,则向上层清液中加入少量BaCl2溶液,应无沉淀生成,否则,则沉淀不完全,故答案为:取少量滤液2,加入盐酸酸化,再滴加少量BaCl2溶液,若无沉淀生成,则说明已沉淀完全。
(4)经过步骤①和②后,溶液中有过量的NaOH和Na2CO3,可以通过加盐酸来除去:HCl+NaOH=H2O+NaCl、Na2CO3+2HCl=2NaCl+CO2↑+H2O,离子方程式为:H++OH-=H2O、CO32-+2H+=CO2↑+H2O,故答案为:H++OH-=H2O、CO32-+2H+=CO2↑+H2O;
(5)经过步骤③后得较纯净的NaCl溶液,通过蒸发结晶、过滤,即可得到NaCl晶体.故答案为:蒸发结晶。

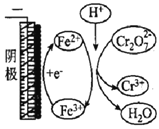
【题目】用电解法处理含Cr2O72-的废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(SO4)3 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2O72-的机理 |
A. 实验ⅱ与实验i对比,其他条件不变,增加c(H+)有利于Cr2O72-的去除
B. 实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于Cr2O72-的去除
C. 实验ⅳ中Fe2+循环利用提高了Cr2O72-的去除率
D. 若实验ⅳ中去除0.01 mol Cr2O72-,生成的阳离子全部转化成沉淀,则沉淀的质量是2.06g