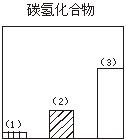
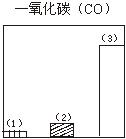
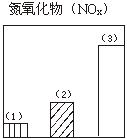
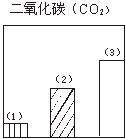
题目内容
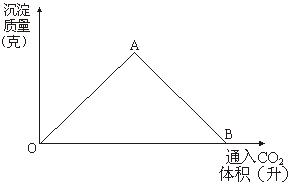
图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。

试回答:
OA段曲线和AB段曲线所表示的反应方程式是:
OA________________________;
AB________________________。
A点时已参加反应的CO2和Ca(OH)2的物质的量之比为________________。
B处溶液中存在浓度较大的两种离子是________和________。(填离子符号)
将B处生成的溶液煮沸,可见到的现象是________________________。
答案:
解析:
解析:
解析:在开始通CO2时,Ca(OH)2过量CO2不足,发生反应Ca(OH)2+CO2══CaCO3↓+H2O,随CO2的不断通入;CaCO3不断增加,至点A时恰好完全反应。Ca(OH)2与CO2的物质的量之比为1∶1。当再继续通入CO2时发生反应CaCO3+CO2+H2O══Ca(HCO3)2,达到B点时恰好完全反应,此时溶液中浓度较大的离子为Ca2+和HCO3-,由于Ca(HCO3)2不稳定,受热时发生反应Ca(HCO3)2 答案:Ca(OH)2+CO2══CaCO3↓+H2O CaCO3+CO2+H2O══Ca(HCO3)2 1∶1 Ca2+ HCO3- 生成白色沉淀
|

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 如图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线.试回答:
如图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线.试回答: