题目内容
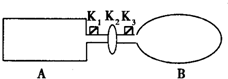
现有一可导热体积固定的密闭容器A,和一可导热容积可变的容器B.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2?N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA______VB.(填“>”、“<”、“=”);若打开活塞K2,气球B将______(填:变大、变小、不变).
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将______,B中NO2的转化率将______(填:变大、变小、不变).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______.
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA______VB.(填“>”、“<”、“=”);若打开活塞K2,气球B将______(填:变大、变小、不变).
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将______,B中NO2的转化率将______(填:变大、变小、不变).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______.

(1)容器A中压强降低,容器B体压强不变,压强越大,反应速率越快,故v(A)<v(B),A中压强小于B中的压强,打开旋塞K,气球B的压强减小,体积减小,
故答案为:<;变小;
(2)保持容器容积不变,通入一定量的NO2,等效为增大压强到达的平衡,增大压强平衡向正反应方向移动,NO2的转化率将增大,故答案为:增大;
保持压强不变,通入氖气使体系的容积增大一倍,反应混合物的浓度降低,相当于为降低压强,平衡向逆反应方向移动,达到平衡时NO2的转化率减小,故答案为:变小;
(3)该反应为放热反应,A套上一个绝热层,温度升高,平衡逆向移动,NO2的浓度增大,颜色变深,故答案为:A;
(4)设参加反应的二氧化氮为xmol,n(NO2)=
=
=0.1mol
2NO2 ?N2O4
起始的量:0.1mol 0
反应的量:x
平衡的量:0.1-x
平衡时平均相对分子质量=
=57.5,所以x=0.04mol,所以平衡时平衡时N2O4的物质的量为:
=0.02mol,
故答案为:0.02mol.
故答案为:<;变小;
(2)保持容器容积不变,通入一定量的NO2,等效为增大压强到达的平衡,增大压强平衡向正反应方向移动,NO2的转化率将增大,故答案为:增大;
保持压强不变,通入氖气使体系的容积增大一倍,反应混合物的浓度降低,相当于为降低压强,平衡向逆反应方向移动,达到平衡时NO2的转化率减小,故答案为:变小;
(3)该反应为放热反应,A套上一个绝热层,温度升高,平衡逆向移动,NO2的浓度增大,颜色变深,故答案为:A;
(4)设参加反应的二氧化氮为xmol,n(NO2)=
| m |
| M |
| 4.6g |
| 46g/mol |
2NO2 ?N2O4
起始的量:0.1mol 0
反应的量:x
| x |
| 2 |
平衡的量:0.1-x
| x |
| 2 |
平衡时平均相对分子质量=
| 4.6 | ||
0.1-x+
|
| x |
| 2 |
故答案为:0.02mol.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目