题目内容
8.根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是( )| A. | 电解水 | B. | 干冰受热直接变成气体 | ||
| C. | HCl溶解于水 | D. | 打雷放电时,O2变成O3 |
分析 化学键包括离子键和共价键,当发生化学反应,电解质的电离以及离子晶体的熔融时,可发生化学键的断裂,而分子晶体的聚集状态的改变只克服分子间作用力,以此解答该题.
解答 解:A.电解水生成氢气和氧气,水中O-H键断裂,故A不选;
B.干冰为分子晶体,受热直接变成气体,克服分子间作用力,故B选;
C.HCl为电解质,溶于水发生电离,共价键断裂,故C不选;
D.打雷放电时,O2变成O3,发生化学变化,共价键断裂,故D不选.
故选B.
点评 本题考查化学键知识,为高频考点,侧重于基本概念的考查,题目难度不大,注意化学键与分子间作用力的区别.

练习册系列答案
相关题目
18.若要使0.5mol CH4完全和Cl2发生取代反应,并生成相同物质的量的4种取代产物,则生成HCl的物质的量为( )
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
19.下列用系统命名法命名的有机物名称正确的是( )
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,2,4-三甲基-1-丁醇 | D. | 2,3-二乙基-1-戊烯 |
16.下列不是离子化合物的是( )
| A. | H2O | B. | CaI2 | C. | KOH | D. | NaNO3 |
3.已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol•L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
HSO3-+H2O?H2SO3+OH- ①
HSO3-?H++SO32- ②
向0.1mol•L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | 加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+$\frac{1}{2}$c(SO32-) | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$、$\frac{c(O{H}^{-})}{c({H}^{+})}$的值均增大 | |
| D. | 加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
13.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断正确的是以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | |
| B. | M和T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 单质与等浓度的稀盐酸反应的剧烈程度为Q>L | |
| D. | L2+与R2-的核外电子数相等 |
17.鉴别红棕色的溴蒸汽和二氧化氮,可采用的方法是( )
| A. | 通入淀粉碘化钾溶液中 | B. | 通入硝酸银溶液 | ||
| C. | 加蒸馏水 | D. | 通入氯气 |
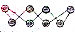 )所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.
)所示,该单质与NaOH溶液反应时产物之一为Na2SO3,写出该反应的离子方程式:3S8+48OH-=16S2-+8SO32-+24H2O.