��Ŀ����
����Ŀ���Ȼ���ͭ(CuCl)�������л��ϳɹ�ҵ�еĴ�������һ�ְ�ɫ��ĩ������ˮ���������Ҵ���ϡ���ᡣ��ҵ��������ӡˢ��·�ķ�Һ(��Fe3����Cu2����Fe2����Cl��)����CuCl��������ͼ��ʾ��
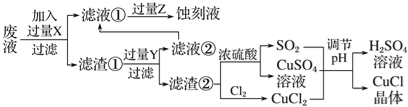
����������Ϣ�ش��������⣺
��1��д������������X________��Y________(�ѧʽ)��
��2��������CuCl���岻��ˮ������ˮ�Ҵ�ϴ�ӵ�Ŀ����________________________�����������е�����Һ��pH���ܹ����ԭ����________________________��
��3��д������CuCl�Ļ�ѧ����ʽ��__________________________________��
��4����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��������_________________��
��5����֪��������Ksp(CuCl)=1.6��10-7��Ksp(CuI)=1.2��10-12������CuCl������Һ�м���NaI������c(I-)=0.1mol/L����ʱ��Һ��c(Cu+)/c(Cl-)=________��
��6���Ȼ���ͭ�Ķ�������
�ٳ�ȡ��Ʒ0.25 g�����ѷ���10 mL������FeCl3��Һ����ƿ�У�����ҡ����
�ڴ���Ʒ�ܽ��ˮ50 mL���ڷ�����ָʾ��2�Ρ�
��������0.10 mol��L��1���������Һ�ζ����յ㣬ͬʱ���հ�ʵ��һ�Ρ�
��֪��
CuCl��FeCl3===CuCl2��FeCl2��Fe2����Ce4��===Fe3����Ce3����
������ظ�2�β�ã�
1 | 2 | 3 | |
�հ�ʵ������������ ����Һ�����/mL | 0.75 | 0.50 | 0.80 |
0.25 g��Ʒ���������� ����Һ�����/mL | 24.65 | 25.75 | 24.90 |
�����ݴ����������CuCl�Ĵ���Ϊ_________(ƽ��ʵ�������ܳ���0.3%)��
���𰸡� Fe HCl ���ٲ�ƷCuCl����ʧ ��ֹCuClˮ�� CuCl2��CuSO4��SO2��2H2O===2CuCl����2H2SO4 Cu��2H2SO4(Ũ)===CuSO4��SO2����2H2O��Ӧ�����ɵ�CuSO4��SO2�����ʵ�����Ϊ1��1��CuCl2��CuSO4��SO2��2H2O===2CuCl����2H2SO4��Ӧ������CuSO4��SO2�����ʵ�����ҲΪ1��1�����������ϲ���Ҫ����SO2���� 9��10-8 95.52%
����������ҵ��������ӡˢ��·�ķ�Һ����Fe3����Cu2����Fe2����Cl����������������ۣ����������������۷�Ӧת��Ϊ���������ӣ�ͭ����������Ӧ����ͭ��Ȼ����ˣ�����Ϊ�������������ɵ�ͭ������ͭ���������ԣ��������������ᣬͭ�������Ӧ�����˵õ�������Ϊͭ��Ȼ��ͭ��Ũ���ᷴӦ��������ͭ�Ͷ�������ͭ��������Ӧ�����Ȼ�ͭ������ͭ�����������Ȼ�ͭ��Ӧ�����Ȼ���ͭ������Һ�ټ��Ȼ�������Һ��ͨ������ת��Ϊ�Ȼ��������»�ÿ�ʴҺ��
��1���������Ϸ�����֪����������X��Y�ֱ���Fe��HCl����2���Ȼ���ͭ(CuCl)����ˮ���������Ҵ���ϡ���ᣬ���������CuCl���岻��ˮ������ˮ�Ҵ�ϴ�ӵ�Ŀ���Ǽ���CuCl����ʧ�����������е�����Һ��pH���ܹ����ԭ���Ƿ�ֹCuClˮ�⣻��3������ͼʾ��֪��CuCl2��CuSO4��SO2��H2O��Ӧ����H2SO4��CuCl������CuCl�Ļ�ѧ����ʽ���ݵ�ʧ�����غ�õ���CuCl2��CuSO4��SO2��2H2O��2CuCl����2H2SO4����4������ͼʾ��֪��Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O��Ӧ�����ɵ�CuSO4��SO2Ϊ1��1��CuCl2��CuSO4��SO2��2H2O��2CuCl����2H2SO4��Ӧ������CuSO4��SO2ҲΪ1�s1�����������ϲ���Ҫ����SO2���塣��5����֪��������Ksp(CuCl)��1.6��10-7��Ksp(CuI)��1.2��10-12������CuCl������Һ�м���NaI������c(I-)��0.1mol/L�������Ksp(CuI)��1.2��10-12��֪��ʱc(Cu+)��1.2��10-11mol/L������Ksp(CuCl)=1.6��10-7��֪��ʱc(Cl-)��
CuSO4+SO2��+2H2O��Ӧ�����ɵ�CuSO4��SO2Ϊ1��1��CuCl2��CuSO4��SO2��2H2O��2CuCl����2H2SO4��Ӧ������CuSO4��SO2ҲΪ1�s1�����������ϲ���Ҫ����SO2���塣��5����֪��������Ksp(CuCl)��1.6��10-7��Ksp(CuI)��1.2��10-12������CuCl������Һ�м���NaI������c(I-)��0.1mol/L�������Ksp(CuI)��1.2��10-12��֪��ʱc(Cu+)��1.2��10-11mol/L������Ksp(CuCl)=1.6��10-7��֪��ʱc(Cl-)��![]() mol/L��������Һ��c(Cu+)/c(Cl-)��9��10-8����6��������Ŀ���������ݼ�ƽ��ʵ�������ܳ���0.3%��֪�ζ�0.25g��Ʒ�������������Һ��ƽ�������24.0mL����Ϸ���ʽCuCl��FeCl3��CuCl2��FeCl2��Fe2����Ce4����Fe3����Ce3����֪CuCl�Ĵ���Ϊ24.0��10-3L��0.1 molL-1��99.5gmol-1/0.25g��100%��95.52%��
mol/L��������Һ��c(Cu+)/c(Cl-)��9��10-8����6��������Ŀ���������ݼ�ƽ��ʵ�������ܳ���0.3%��֪�ζ�0.25g��Ʒ�������������Һ��ƽ�������24.0mL����Ϸ���ʽCuCl��FeCl3��CuCl2��FeCl2��Fe2����Ce4����Fe3����Ce3����֪CuCl�Ĵ���Ϊ24.0��10-3L��0.1 molL-1��99.5gmol-1/0.25g��100%��95.52%��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��X��Y��Z��W��Ԫ�����ڱ�ǰ��������ԭ��������������ij���Ԫ�أ��������Ϣ���±���
Ԫ�� | �����Ϣ |
X | X��ij���⻯����ʹʪ��ĺ�ɫʯ����ֽ���� |
Y | Y��һ�ֺ���������Ϊ24��������Ϊ12 |
Z | Z�ĵ��������õİ뵼����ϣ��㷺Ӧ���ڹ����Ϣ���� |
W | W������������Ӧˮ������һ�ֲ�����ˮ����ɫ���� |
�ش��������⣺
(1)Y��Ԫ�����ڱ��е�λ����________��X��Z�ļ���̬�⻯���ȶ��Խ�������____���ѧʽ����
(2)X��һ���⻯��X2H4�ķ����м��Լ��ͷǼ��Լ���Ŀ��Ϊ_______��Y���Ȼ������ʽΪ________��
(3)W��������(W2O)��X������������Ӧ��ˮ���ﷴӦ����XO�����ӷ���ʽΪ_______��
����Ŀ��̼���仯�������о�����������������Ҫ��;����ش��������⣺
��1����̬̼ԭ�Ӻ��������__�ֿռ��˶�״̬����۵����Ų�ͼΪ__��
��2�������ķ���ʽΪCOCl2���ֳ�̼���ȣ���һ����Ҫ�ĺ�̼������ж���������幹��Ϊ__����̼ԭ���ӻ��������Ϊ_____�ӻ���
��3��̼������һ���¶��»ᷢ���ֽ⣬ʵ��֤��̼���ε������Ӳ�ͬ���ֽ��¶Ȳ�ͬ�����±���ʾ��
̼���� | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
�ȷֽ��¶�/�� | 402 | 900 | 1172 | 1360 |
�����Ӱ뾶/pm | 66 | 99 | 112 | 135 |
�Խ���Ϊʲô���������Ӱ뾶������̼���εķֽ��¶������ߣ��� ______________
��4��̼��һ��ͬ�������婁��C60����������ϩ����һ�ָ߶ȶԳƵ���̼���ӣ������飨����ʽ��C8H8�ṹ�������壺![]() �DZ�C60Լ��20��ϳɳ���һ�ֶԳ���������ӣ���������Ѻϳɳ�һ����������C60�ĸ����ͷ��Ӿ��壬�þ���ľ����ṹ��ͼ��ʾ����������������ԭC60����ķ��Ӽ�������϶�У���ø����ͷ��Ӿ��������ö��ߵķ���ʽ�ɱ�ʾΪ__��
�DZ�C60Լ��20��ϳɳ���һ�ֶԳ���������ӣ���������Ѻϳɳ�һ����������C60�ĸ����ͷ��Ӿ��壬�þ���ľ����ṹ��ͼ��ʾ����������������ԭC60����ķ��Ӽ�������϶�У���ø����ͷ��Ӿ��������ö��ߵķ���ʽ�ɱ�ʾΪ__��

��5��̼����һ��ͬ�������塪��ʯī���侧��ṹ��ͼ��ʾ����ʯī������̼ԭ�Ӹ���Ϊ__������֪ʯī���ܶ�Ϊ��g��cm��3��C��C����Ϊrcm�������ӵ�������ֵΪNA������ʯī����IJ���Ϊ__cm��
��6�����ʯ��ʯī���������ʲ���ܴ����У��۵�ϸߵ���___________���Դӽṹ����___________��Ӳ�ȴ����___________����ṹԭ����___________��

