题目内容
【题目】已知:I2+2S2O32﹣═S4O62﹣+2I﹣
相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10﹣20 | 2.6×10﹣39 | 1.7×10﹣7 | 1.3×10﹣12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3 , 为得到纯净的CuCl22H2O晶体,加入 , 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= . 过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体.
(2)在空气中直接加热CuCl22H2O晶体得不到纯的无水CuCl2 , 原因是(用化学方程式表示).由CuCl22H2O晶体得到纯的无水CuCl2的合理方法是 .
(3)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I﹣发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0molL﹣1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用作滴定指示剂,滴定终点的现象是 .
②CuCl2溶液与KI反应的离子方程式为 .
③该试样中CuCl22H2O的质量百分数为
【答案】
(1)CuO或Cu(OH)2或Cu2(OH)2CO3;2.6×10﹣9mol/L
(2)2CuCl2?2H2O ![]() Cu(OH)2?CuCl2+2HCl+2H2O;在干燥的HCl气流中加热脱水
Cu(OH)2?CuCl2+2HCl+2H2O;在干燥的HCl气流中加热脱水
(3)淀粉溶液;蓝色褪去,放置一定时间后不恢复原色;2Cu2++4I﹣=2CuI↓+I2;95%
【解析】解:(1)为得到纯净的CuCl22H2O晶体要除去氯化铁,加入的物质和氯化铁反应生成氢氧化铁且不能引进新的杂质,所以加入物质后应能转化为氯化铜,所以应该加入含铜元素和氢氧根离子的物质,可以是氧化铜或氢氧化铜或碱式碳酸铜,溶液的pH=4,所以溶液中氢离子浓度为10﹣4 mol/L,则氢氧根离子浓度为10﹣10 mol/L,c(Fe3+)= ![]() =
= ![]() =2.6×10﹣9mol/L,
=2.6×10﹣9mol/L,
所以答案是:CuO或Cu(OH)2或Cu2(OH)2CO3 ;2.6×10﹣9mol/L;(2)由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,碱式氯化铜或氢氧化铜,以至于得到CuO固体,而不是CuCl2 , 2CuCl22H2O ![]() Cu(OH)2CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl22H2O晶体在干燥的HCl气流中加热脱水,
Cu(OH)2CuCl2+2HCl+2H2O;想得到无水CuCl2的合理方法是,让CuCl22H2O晶体在干燥的HCl气流中加热脱水,
所以答案是:2CuCl22H2O ![]() Cu(OH)2CuCl2+2HCl+2H2O;在干燥的HCl气流中加热脱水;(3)测定含有CuCl22H2O晶体的试样(不含能与I﹣发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL;反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,
Cu(OH)2CuCl2+2HCl+2H2O;在干燥的HCl气流中加热脱水;(3)测定含有CuCl22H2O晶体的试样(不含能与I﹣发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL;反应的化学方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,
①硫代硫酸钠滴定碘单质,利用碘单质遇淀粉变蓝选择指示剂为淀粉;终点为蓝色褪去一段时间不恢复颜色,
所以答案是:淀粉溶液;蓝色褪去,放置一定时间后不恢复原色;
②CuCl2溶液与KI反应的离子方程式为为:2Cu2++4I﹣=2CuI↓+I2 , 所以答案是:2Cu2++4I﹣=2CuI↓+I2;
③依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I﹣=2CuI↓+I2;
得到
2Na2S2O3 | ~ | 2Cu2+ |
2 | 2 | |
0.1000mol/L×0.0200L | 0.1000mol/L×0.0200L =0.002mol |
试样中CuCl22H2O的质量百分数= ![]() ×100%=95%,
×100%=95%,
所以答案是:95%.

【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
【答案】C
【解析】A.铜粉与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质,故A错误;B.二者均与Fe反应,不符合除杂的原则,不能除杂,故B错误;C.Al与NaOH溶液反应,而Fe不能,则加NaOH溶解后过滤可除杂,故C正确;D.二者均与BaCl2溶液反应,应加适量硫酸除杂,故D错误;故选C。
【题型】单选题
【结束】
19
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
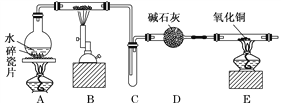
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。





