题目内容
4.下表列出了8种元素在周期表中的位置,用化学式或元素符号回答下列问题: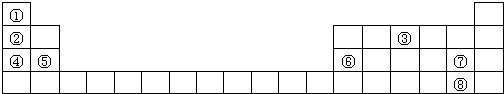
(1)上述元素最高价氧化物对应水化物中,酸性最强是HClO4.
(2)③④⑤原子半径由大到小的顺序是Na、Mg、N.
(3)⑤的单质与水反应的化学方程式是Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑.
(4)③元素的氢化物的电子式为
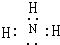 ,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取该氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.(5)②元素的单质与氧气反应的化学方程式为4Li+O2$\frac{\underline{\;点燃\;}}{\;}$2Li2O.
(6)用电子式表示④与⑧形成化合物的过程
 .
.
分析 根据元素在周期表中的位置知,①~⑧分别是H、Li、N、Na、Mg、Al、Cl、Br元素,
(1)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(2)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
(3)镁和沸水反应生成氢氧化镁和氢气;
(4)氨气分子中N原子和每个H原子形成一个共用电子对;实验室用氯化铵和氢氧化钙加热制取氨气;
(5)锂和氧气反应生成氧化锂;
(6)钠和溴通过得失电子形成离子化合物NaBr.
解答 解:根据元素在周期表中的位置知,①~⑧分别是H、Li、N、Na、Mg、Al、Cl、Br元素,
(1)元素的非金属性越强,其最高价氧化物的水化物酸性越强,这几种元素中非金属性最强的是Cl,酸性最强的酸是HClO4,故答案为:HClO4;
(2)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以③④⑤原子半径由大到小的顺序是Na、Mg、N,故答案为:Na、Mg、N;
(3)镁和沸水反应生成氢氧化镁和氢气,反应方程式为Mg+2 H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑,故答案为:Mg+2 H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑;
(4)氨气分子中N原子和每个H原子形成一个共用电子对,氨气电子式为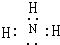 ;实验室用氯化铵和氢氧化钙加热制取氨气,反应方程式为2 NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2 NH3↑+2 H2O,故答案为:
;实验室用氯化铵和氢氧化钙加热制取氨气,反应方程式为2 NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2 NH3↑+2 H2O,故答案为: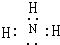 ; 2 NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2 NH3↑+2 H2O;
; 2 NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2 NH3↑+2 H2O;
(5)锂和氧气反应生成氧化锂,反应方程式为4 Li+O2$\frac{\underline{\;点燃\;}}{\;}$2 Li2O,故答案为:4 Li+O2$\frac{\underline{\;点燃\;}}{\;}$2 Li2O;
(6)钠和溴通过得失电子形成离子化合物NaBr, ,故答案为:
,故答案为:
点评 本题考查元素周期表和元素周期律综合应用,涉及方程式的书写、物质结构、元素周期律等知识点,明确元素化合物性质及物质结构等即可解答,难点是用电子式表示化合物形成过程.

| A. | HCl、MgCl2、NH4Cl | B. | H2O、Na2O、金刚石 | C. | NaCl、NaOH、H2O | D. | NH3、H2O、CO2 |
| X | ||
| Y | Z |
| A. | YZ5中各元素原子均为8电子结构 | B. | X形成的物质种类最多 | ||
| C. | X、Y、Z分别是O、P、Cl | D. | Z的单质常温下是固体 |
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 物质的燃烧一定是放热反应 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 化学能与光能之间可以相互转化 |
| A. | [c(H+)•c(OH-)]>1×10-14 | |
| B. | c(Na+)+c(H+)=c(H2XO4-)+c(OH-)+2c(HXO42-)+3c(XO43-) | |
| C. | c(H+)+2c(H3XO4)+c(H2XO4-)=c(XO43-)+c(OH-) | |
| D. | c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-) |
 .
. 、
、 、
、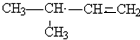 (任意一种);(写出其中的一种)
(任意一种);(写出其中的一种)