题目内容
11.下列叙述中一定能说明A的金属性比B强的是( )| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数多 | |
| C. | 参与反应时1 mol A失去的电子比1 mol B失去的电子多 | |
| D. | 常温时,A能从盐酸中置换出氢气,而B不能反应 |
分析 比较元素的金属性,可通过①最高价氧化物的水化物的碱性强弱;②与水或酸反应的剧烈程度;③金属之间的置换反应等角度.
解答 解:A、金属性强弱和原子的最外层电子数无关,如氢原子最外层只有一个电子,而镁原子最外层两个电子,镁的金属性更强,故A错误;
B、金属性强弱和原子的电子层数多少无关,如氢原子只有一个电子层,而镁原子有三个电子层,镁的金属性更强,故B错误;
C、金属性强弱取决于失电子能力,与失电子多少无关,如Na反应失去1个电子,Mg失去2个电子,金属性钠大于镁,故C错误;
D、常温时,A能从酸中置换出氢气而B不能与酸反应,说明A的金属性比B强,故D正确.
故选D.
点评 本题考查金属性强弱的比较,题目难度不大,注意比较金属性强弱的角度,侧重于考查学生的分析能力,注意根据实例分析.

练习册系列答案
相关题目
1.下列热化学方程式或离子方程式中,正确的是( )
| A. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 甲烷的标准燃烧热△H=-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-═2AlO2-+H2O |
3.能用H++OH-=H2O表示的是( )
| A. | 澄清石灰水和稀硝酸的反应 | B. | Mg(OH)2和稀H2SO4的反应 | ||
| C. | NaOH溶液和碳酸的反应 | D. | 氢气和氧气的反应 |
20.下列关于1.0mol•L-1 Na2SO4溶液的叙述正确的是( )
①溶液中含有1mol Na2SO4 ②1L溶液中含有142g Na2SO4
③将1mol Na2SO4溶于1mol水中所得的溶液 ④将322g Na2SO4•10H2O溶于水后再稀释成1 000mL所得的溶液.
①溶液中含有1mol Na2SO4 ②1L溶液中含有142g Na2SO4
③将1mol Na2SO4溶于1mol水中所得的溶液 ④将322g Na2SO4•10H2O溶于水后再稀释成1 000mL所得的溶液.
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ②③ |
1.下列离子方程式书写正确的是( )
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 已知Ka(HClO)>Ka2(H2CO3),则有:2ClO-+CO2(少量)+H2O═CO32-+2HClO | |
| C. | 金溶于王水生成AuCl4-离子和NO:Au+4H++4Cl-+NO3-═AuCl4-+NO↑+2H2O | |
| D. | 用NaClO溶液吸收过量的SO2:ClO-+SO2+H2O═HSO3-+HClO |
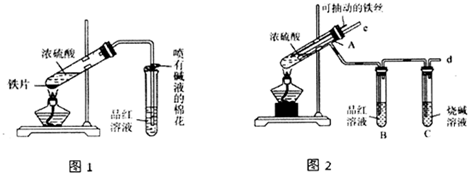
 ,可用于降低血液中的胆固醇,该物质合成线路如图所示:
,可用于降低血液中的胆固醇,该物质合成线路如图所示: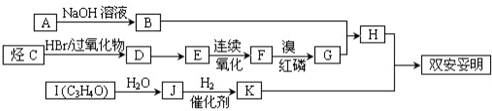
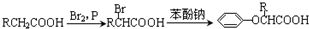
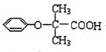 .
. .
.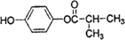 (写结构简式).
(写结构简式). A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系: