题目内容
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)。
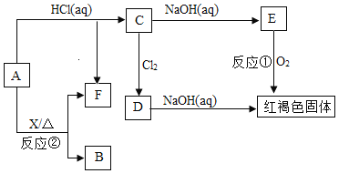
请根据以上信息回答下列问题:
(1)写出物质B的化学式:________。
(2)写出下列反应的化学方程式:
反应①______________________________________。
反应②_______________________________________。
(3)写出下列反应的离子方程式:反应C→D________________________。
(4)检验D中阳离子的方法:_______________。
【答案】Fe3O4 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe+4H2O(g)![]() Fe3O4+4H2 2Fe2++Cl2=2Fe3++2Cl- 取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+
Fe3O4+4H2 2Fe2++Cl2=2Fe3++2Cl- 取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+
【解析】
红褐色固体出现,为氢氧化铁,说明金属单质A为铁,铁与盐酸反应生成氯化亚铁(C)和氢气(F),氯化亚铁被氯气氧化为氯化铁(D),氯化亚铁与氢氧化钠溶液反应生成白色沉淀氢氧化亚铁(E),接着被氧气氧化为红褐色固体氢氧化铁。反应②需要加热,说明铁与水蒸气加热条件下反应生成四氧化三铁(B)和氢气(F);据此解答。
根据以上分析可知A为铁,B为四氧化三铁,C为氯化亚铁,D为氯化铁,E为氢氧化亚铁,F为氢气,则
(1)B为四氧化三铁,化学式为Fe3O4。
(2)反应①是氢氧化亚铁被氧化为氢氧化铁,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;反应②是铁和水蒸气反应,方程式为3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(3)C转化为D是氯化亚铁被氯气氧化为氯化铁,离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(4)Fe3+检验方法为取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+。

【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4工艺流程如下:
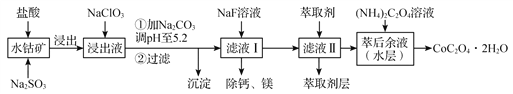
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下Co3+的氧化能力很强。
③部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将还原_________(填离子符号)。
(2)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:___________________________________________。
(3)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=______________________。【 已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.00×10-10】
(4)已知:NH3·H2O![]()
![]() +OH Kb=1.8×105;
+OH Kb=1.8×105;
H2C2O4![]() H++
H++![]() Ka1=5.4×102;
Ka1=5.4×102;
![]() H++
H++![]() Ka2=5.4×105。
Ka2=5.4×105。
所用(NH4)2C2O4溶液中离子浓度由大到小的顺序为______________________。
(5)