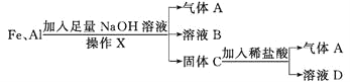
题目内容
【题目】利用如图装置可验证同主族元素非金属性的变化规律。
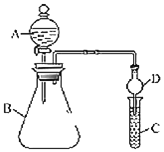
(1)仪器A的名称为______,干燥管D的作用为______。
(2)若要证明非金属性:![]() ,C中为淀粉
,C中为淀粉![]() 碘化钾混合溶液,B中装有
碘化钾混合溶液,B中装有![]() 固体,则A中试剂为______,观察到C中溶液______
固体,则A中试剂为______,观察到C中溶液______![]() 填现象
填现象![]() ,即可证明。从环境保护的观点考虑,此装置缺点______。
,即可证明。从环境保护的观点考虑,此装置缺点______。
(3)若要证明非金属性:![]() ,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
,则在A中______B中加______、C中加______,写出C中反应的化学方程式______
【答案】分液漏斗 防止倒吸 浓盐酸 溶液变蓝色 在装置最后添加盛有碱液的尾气吸收装置 硫酸 ![]() 溶液 硅酸钠溶液
溶液 硅酸钠溶液 ![]()
【解析】
(1)根据仪器A的构造判断其名称;尾气处理装置中,有缓冲装置的能防止倒吸;
(2)浓盐酸和酸性高锰酸钾溶液发生氧化还原反应生成![]() ,
,![]() 能氧化
能氧化![]() 生成
生成![]() ,碘遇淀粉试液变蓝;氯气有毒,图示装置中缺少尾气处理装置;
,碘遇淀粉试液变蓝;氯气有毒,图示装置中缺少尾气处理装置;
(3)元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,若要证明非金属性:![]() ,则需要证明酸性强弱顺序为:硫酸
,则需要证明酸性强弱顺序为:硫酸![]() 碳酸
碳酸![]() 硅酸,利用强酸制弱酸的原理分析即可。
硅酸,利用强酸制弱酸的原理分析即可。
(1)仪器A的名称为分液漏斗;尾气处理装置中,有缓冲装置的能防止倒吸,干燥管有缓冲作用,所以能防止倒吸;
故答案为:分液漏斗;防止倒吸;
(2)浓盐酸和酸性高锰酸钾溶液发生氧化还原反应生成![]() ,则A中试剂为浓盐酸;
,则A中试剂为浓盐酸;![]() 具有氧化性,能氧化
具有氧化性,能氧化![]() 生成
生成![]() ,碘遇淀粉试液变蓝色,C装置中看到的现象是溶液变蓝色;氯气有毒,需要添加尾气吸收装置,可以用碱液吸收氯气,所以改进措施为:在装置最后添加盛有碱液的尾气吸收装置;
,碘遇淀粉试液变蓝色,C装置中看到的现象是溶液变蓝色;氯气有毒,需要添加尾气吸收装置,可以用碱液吸收氯气,所以改进措施为:在装置最后添加盛有碱液的尾气吸收装置;
故答案为:浓盐酸;溶液变蓝色;在装置最后添加盛有碱液的尾气吸收装置;
(3)证明非金属性:![]() ,则需要证明酸性强弱顺序为:硫酸
,则需要证明酸性强弱顺序为:硫酸![]() 碳酸
碳酸![]() 硅酸,根据强酸制弱酸的原理可知A中试剂为稀硫酸,B中试剂为碳酸钠,C中试剂为硅酸钠溶液,C中硅酸钠溶液中通入CO2气体,有白色胶状沉淀生成,发生反应的化学方程式为
硅酸,根据强酸制弱酸的原理可知A中试剂为稀硫酸,B中试剂为碳酸钠,C中试剂为硅酸钠溶液,C中硅酸钠溶液中通入CO2气体,有白色胶状沉淀生成,发生反应的化学方程式为![]() ;
;
故答案为:硫酸;![]() 溶液;硅酸钠溶液;
溶液;硅酸钠溶液;![]() 。
。