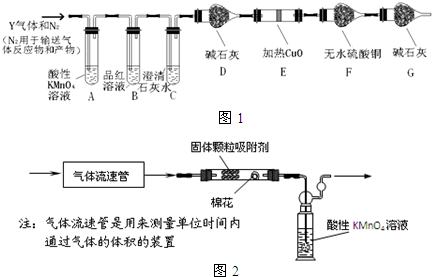
题目内容
4.已知NaOH+Al(OH)3→Na[Al(OH)4].向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起.上述实验过程中没有发生的离子反应是( )| A. | CO2+2OH-→CO32-+H2O | B. | Al2O3+2OH-+3H2O→2[Al(OH)4]- | ||
| C. | 2Al+2OH-+6H2O→2[Al(OH)4]-+3H2↑ | D. | Al3++4OH-→[Al(OH)4]- |
分析 向集满CO2的铝罐中加入过量氢氧化钠,首先CO2与氢氧化钠反应,发生反应为:CO2+2OH-→CO32-+H2O,表现为铝罐变瘪;接着过量的氢氧化钠再与铝罐反应生成氢气,发生反应为:2Al+2OH-+6H2O→2[Al(OH)4]-+3H2↑,则罐壁又重新凸起;因铝罐表面有氧化膜Al2O3,则又能够发生反应:Al2O3+2OH-+3H2O→2[Al(OH)4]-,据此进行解答.
解答 解:向集满CO2的铝罐中加入过量氢氧化钠,首先CO2与氢氧化钠反应,发生反应为:CO2+2OH-→CO32-+H2O,表现为铝罐变瘪;接着过量的氢氧化钠再与铝罐反应生成氢气,发生反应为:2Al+2OH-+6H2O→2[Al(OH)4]-+3H2↑,则罐壁又重新凸起;
因铝罐表面有氧化膜Al2O3,则又能够发生反应:Al2O3+2OH-+3H2O→2[Al(OH)4]-,
根据分析可知,能够发生反应为A、B、C的,没有发生的反应为D,
故选D.
点评 本题考查了铝及其化合物性质,题目难度不大,明确发生反应原理为解答关键,注意掌握铝及其化合物性质,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
14.利用如图所示装置及表中的试剂,能达到相应实验目的是( )
| 选项 | 试剂甲 | 试剂乙 | 实验目的 | 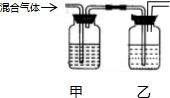 |
| A | NaOH溶液 | 浓硫酸 | 从等体积NO、NH3和NO2中分离出NO | |
| B | KMnO4溶液 | 浓硫酸 | 除去Cl2中的SO2、HCl得干燥Cl2 | |
| C | 溴水 | 浓H2SO4 | 除去乙炔中的H2S和H2O(g) | |
| D | 品红溶液 | 石灰水 | 检验混合气体HCl、SO2、CO2中的SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |
12.下列说法正确的是( )
| A. | 水是无机物,故有机物在水中的溶解度都很小 | |
| B. | 氢键对物质的溶解性没有影响 | |
| C. | 溶质能与水发生化学反应将增大其在水中的溶解度 | |
| D. | CO与水都是极性分子,故CO易溶于水 |
19.图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )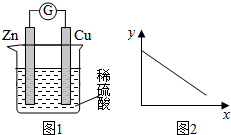

| A. | 铜棒的质量 | B. | c(Zn2+) | C. | c(H+) | D. | c(SO42-) |
10.有五个系列同族元素的物质,101.3kP时测定它们的沸点(℃)如下表所示:
对应表中内容,下列叙述中正确的有多少句( )
(1)a、b、c的化学式分别为Ne、Br2、HF
(2)系列②物质均有氧化性;系列③物质对应水溶液均是强酸
(3)系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
(4)上表内物质HF和H2O,由于氢键的影响,其分子特别稳定.
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2-187.0 | Cl2-33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| ⑤ | CH4-161.0 | SiH4-112.0 | GeH4-90.0 | (e)-52.0 |
(1)a、b、c的化学式分别为Ne、Br2、HF
(2)系列②物质均有氧化性;系列③物质对应水溶液均是强酸
(3)系列④中各化合物的稳定性顺序为:H20>H2S>H2Se>H2Te
(4)上表内物质HF和H2O,由于氢键的影响,其分子特别稳定.
| A. | 仅有一句 | B. | 两句 | C. | 三句 | D. | 全部正确 |
8.现有下列短周期元素性质的数据:
试回答下列问题:
(1)上述元素中处于同一主族的有④和⑦、③和⑥,处于第3周期的有②④⑤⑥(以上均用 编号表示).
(2)元素④与元素⑦相比较,气态氢化物较稳定的是NH3(填气态氢化物的化学式).
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与CO2反应的化学方程式:2Na2O2+2CO2=Na2CO3+O2;
(4)上表中某元素最高价氧化物对应的水化物能溶于盐酸和氢氧化钠,该元素的单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
| 元素编号元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于同一主族的有④和⑦、③和⑥,处于第3周期的有②④⑤⑥(以上均用 编号表示).
(2)元素④与元素⑦相比较,气态氢化物较稳定的是NH3(填气态氢化物的化学式).
(3)元素①、⑥能形成两种化合物,写出其中较稳定的化合物与CO2反应的化学方程式:2Na2O2+2CO2=Na2CO3+O2;
(4)上表中某元素最高价氧化物对应的水化物能溶于盐酸和氢氧化钠,该元素的单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
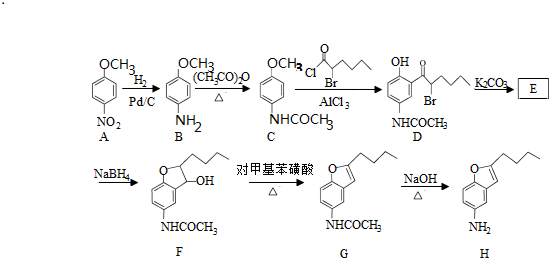
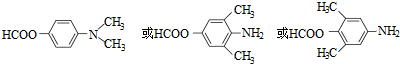 .
.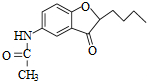 .
.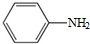 )易被氧化
)易被氧化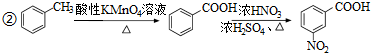
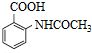 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干). ;
; ;
;