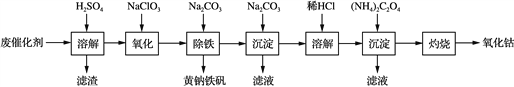
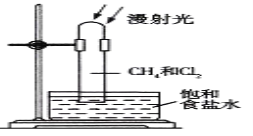
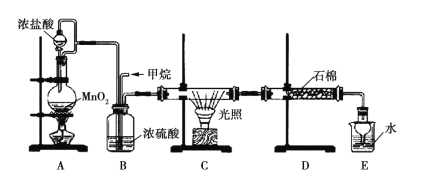
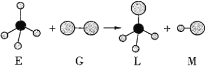
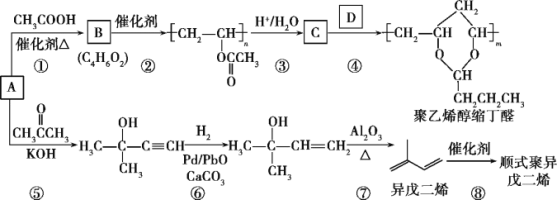
��Ŀ����
����Ŀ����1���ݱ������ҹ����Ϻ����еĿ�ȼ��(�����ˮ����)�Բɻ�óɹ���������һ����Ҫ�Ļ���ԭ�ϡ���������������������ʵ���Ҫ��ʽ����������������������֣�
ˮ����������CH4(g)��H2O(g)![]() CO(g)��3H2(g) ��H1����205.9kJ��mol��1 ��
CO(g)��3H2(g) ��H1����205.9kJ��mol��1 ��
CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H2����41.2kJ��mol��1 ��
CO2(g)��H2(g) ��H2����41.2kJ��mol��1 ��
������̼������CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��H3 ��
2CO(g)��2H2(g) ��H3 ��
��Ӧ���Է����е�������___������¡����¡�������H3��__kJ��mol��1��
��2�����ݲ��ּ������ݣ��Լ��Ȼ�ѧ����ʽCH4(g)��4F2(g)=CF4(g)��4HF(g) ��H=��1940kJ��mol-1������H��F���ļ���Ϊ__kJ��mol-1��
��ѧ�� | C��H | C��F | H��F | F��F |
����/(kJ��mol��1) | 414 | 489 | �� | 155 |
��3��0.1mol�������ͽ�̿��TiO2������ȫ��Ӧ������TiCl4Һ���CO���壬�ų�����4.28kJ��д���÷�Ӧ���Ȼ�ѧ����ʽ___��
���𰸡����� ��247.1 565 2Cl2(g)+2C(s)+TiO2(s)=TiCl4(l)+2CO(g) ��H =��85.6kJ��mol-1
��������
��1����Ӧ���Է��Ը�����G=��H-T��S<0�����жϣ����ø���˹������д��ȷ���Ȼ�ѧ����ʽ��
��2��������H =��Ӧ����ܼ���-��������ܼ��ܽ��м��㣻
��3��0.1mol�������ͽ�̿��TiO2������ȫ��Ӧ������TiCl4Һ���CO���壬�ų�����4.28kJ����ô2mol�������ͽ�̿��TiO2������ȫ��Ӧ������TiCl4Һ���CO���壬�ų�����85.6kJ���ݴ�д���Ȼ�ѧ����ʽ��
��1���ɷ�Ӧ�ٿ�֪��H>0����S>0������Ӧ���Է����У���ô��G=��H-T��S<0��ֻ���÷�Ӧ�ڸ����·������ɣ��ɷ�Ӧ��-�ڿɵ�CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��H3=+247.1 kJ��mol-1��
2CO(g)��2H2(g) ��H3=+247.1 kJ��mol-1��
��2����H =��Ӧ����ܼ���-��������ܼ���=(4��414 kJ��mol-1)+ (4��155 kJ��mol-1)- (4��489 kJ��mol-1)- (4��E(H-F))=-1940 kJ��mol-1�����E(H-F)=565 kJ��mol-1��
��3��0.1mol�������ͽ�̿��TiO2������ȫ��Ӧ������TiCl4Һ���CO���壬�ų�����4.28kJ����ô2mol�������ͽ�̿��TiO2������ȫ��Ӧ������TiCl4Һ���CO���壬�ų�����85.6kJ���Ȼ�ѧ����ʽΪ2Cl2(g)+2C(s)+TiO2(s)=TiCl4(l)+2CO(g) ��H =��85.6kJ��mol-1��

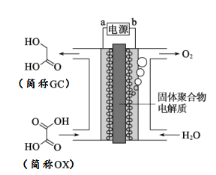
 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�����Ŀ���л���A���������Ƿ��͵õ���Ҳ�ɴ���ţ������ȡ��������AΪ��ɫճ��Һ�壬������ˮ��Ϊ�о�A�������ṹ������������ʵ�飺
ʵ�鲽�� | ���ͻ�ʵ����� |
�ٳ�ȡA 9.0g������ʹ�������������ܶ�����ͬ������H2��45���� | ��ͨ��������գ� (1)A����Է�������Ϊ______ |
�ڽ���9.0g A��������O2�г��ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ң��������߷ֱ�����5.4g��13.2g�� | (2)A�ķ���ʽΪ______ |
����ȡA9.0g����������NaHCO3��ĩ��Ӧ������2.24L CO2(��״��)���������������Ʒ�Ӧ������2.24L H2(��״��) | (3)���л�������к����ǻ����Ȼ���1mol���ǻ��ĵ���ʽΪ______ |
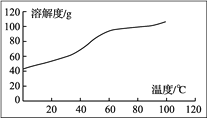
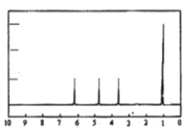
��A�ĺ˴Ź���������ͼ��
| (4)A�к���______����ԭ�� |
������������A�Ľṹ��ʽ______ |