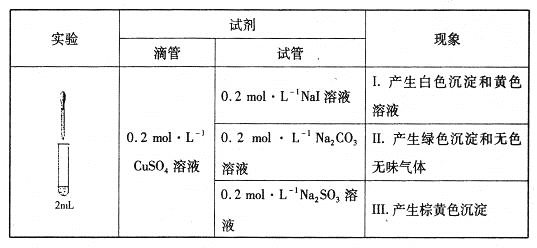
题目内容
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:________________;(填编号)
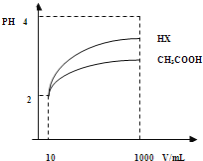
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_________________,稀释后,HX溶液中水电离出来的c(H+)_______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=____________________.(填准确数值).
【答案】a>b>d>c 大于 HX的pH变化程度大,则酸性HX强,电离平衡常数大 大于 稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小 9.9×10﹣7mol/L
【解析】
(1)由电离平衡常数判断酸性的强弱,酸性越强,其对应盐的水解程度越大,溶液的pH就越大;
(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX比CH3COOH强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大;
(3)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L。
(1)由电离平衡常数判断酸性的强弱,酸性越强,其对应盐的水解程度越大,溶液的pH就越大,由表格中的数据可知,酸性CH3COOH>H2CO3>HClO>HCO3-,物质的量浓度为0.1mol/L四种盐的水解程度为a>b>d>c,pH由大到小的顺序是a>b>d>c,故答案为:a>b>d>c;
(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX比CH3COOH强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大,故答案为:大于;HX的pH变化程度大,则酸性HX强,电离平衡常数大;大于;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小;
(3)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,故答案为:9.9×10-7mol/L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:

已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Al3+ | 3.3 | 5.0 |
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
温度/℃ | 10 | 20 | 30 | 40 | 50 |
FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________;检验溶液1中含有Fe3+的实验方法是___________________;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________;
(3)试剂X是__________________;固体2是___________________;
(4)加入NaOH溶液控制pH应不超过_________________;
(5)从溶液2中获得晶体的的方法为______________, _____________过滤、洗涤、干燥。