��Ŀ����
����Ŀ����������ͼʾ����������ȷ����
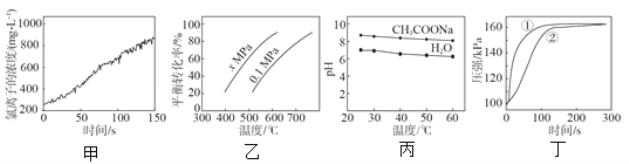
A.����������ˮ���չ�����������Ũ�ȵı仯���ߣ��ƶϴ�����ֽ������� HCl �� O2
B.���� C4H10(g)![]() C4H8(g) + H2(g)��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ���ߣ��ƶϸ÷�Ӧ��H��0��x��0.1
C4H8(g) + H2(g)��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ���ߣ��ƶϸ÷�Ӧ��H��0��x��0.1
C.���� 0.03g þ���ֱ��� 2 mL 2 mol/L ����ʹ��ᷴӦ�������ܱ�����������ѹǿ��ʱ��ı仯���ߣ��ƶϢٴ���������þ���ķ�Ӧ
D.���� 0.5 mol/L CH3COONa ��Һ��ˮ�� pH ���¶ȵı仯���ߣ�˵�����¶����ߣ�CH3COONa ��Һ�� c(OH-)��С
���𰸡�C
��������
A����������ˮ�д��ڿ��淴ӦCl2+H2OH++Cl-+HClO���Ӽ�ͼ�п��Կ��������Ź��յIJ��Ͻ��У�������ˮ��c(Cl-)���������ɴ˿��ƶϴ�����ֽ������� HCl�������ܿ϶��Ƿ���O2���ɣ�A����ȷ��
B������ͼ�п��Կ����������¶ȣ�C4H10(g)![]() C4H8(g) + H2(g)��ƽ��ת���������������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ��H��0��ѹǿ��0.1MPa��ΪxMPaʱ��ƽ��ת�������������ƽ�������ƶ�������ӦΪ��Сѹǿ��x<0.1��B����ȷ��
C4H8(g) + H2(g)��ƽ��ת���������������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ��H��0��ѹǿ��0.1MPa��ΪxMPaʱ��ƽ��ת�������������ƽ�������ƶ�������ӦΪ��Сѹǿ��x<0.1��B����ȷ��
C������ΪһԪǿ�ᣬ����ΪһԪ���ᣬ2 mL 2 mol/L ����ʹ����У�������c(H+)����0.03g þ����Ӧ�����ʴ���ͬʱ���ڲ������������࣬���ղ�����H2������ȣ��Ӷ�ͼ�п��Կ����ٵķ�Ӧ���ʿ죬�ɴ˿��ƶϢٴ���������þ���ķ�Ӧ��C��ȷ��
D��0.5 mol/L CH3COONa ��Һ��ˮ�У���������ƽ�⣺CH3COO-+H2OCH3COOH+OH-��H2OH++OH-��CH3COO-��ˮ���ˮ�ĵ��붼�����ȹ��̣������¶�ƽ�������ƶ�������CH3COONa��Һ��c(OH-)����D����ȷ��
��ѡC��

����Ŀ��������ѧ��ѧ����Ԫ��ԭ�ӽṹ���������±���ʾ
Ԫ�� | �ṹ������ |
A | Ԫ��A�ڵ��������м����Ӱ뾶��С |
B | Bԭ���������������ڲ��������0.6 |
C | ʹ����㷺�Ľ���Ԫ��C���γ������Ȼ������Է�������֮��Ϊ35.5 |
D | Ԫ��D��Bͬ���壬�Ҵ���������D���������ϼ� |
E | Ԫ��E�����ڱ���λ����A�壬������Ϊ����������A��Ҳ��һ������ |
F | Ԫ��F��Bͬ���ڣ�������������ˮ������A��B������������ˮ������ܷ�Ӧ |
(1)Ԫ��C�����ڱ��е�λ����____Ԫ�أ�Ԫ��E�γɵ�һ�ּ�������֧������Ԫ��E������A������һ�۵㣬�����ӵĽṹʾ��ͼΪ___��
(2)Ԫ��E��D����ԭ�Ӹ�����2��1��1��1�γ����ֻ�����X��Y������X��Y���������ʵ�ʵ�鷽��Ϊ __��E��B�γɵ�һ�ֻ�����Z��X��Y�е�һ�ֵ���������ͬ���ܷ�����ѧ��Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��___(����Ӧ��ѧʽ��ʾ)��
(3)�뻭��������F2B2�ĵ���ʽ��_____���û������к��еĻ�ѧ��������___��
(4)Ԫ��A��Ԫ��F��ȣ������Խ�ǿ����_________ (��Ԫ�ط��ű�ʾ)�����б�����ȷ����֤����һ��ʵ����___(����ĸ����)��
a����Ӧ�������ᷴӦʱ��ÿ��Aԭ�ӱ�ÿ��Fԭ��ʧ���Ӷ�
b����Ӧ������ͬŨ�����ᷴӦʱ��F��A���ҵö�
c��A���������۵��F���������۵��
d��F�ɽ�A��������Һ���û�����
e������������Ӧ��ˮ����ļ���F��A��ǿ
����Ŀ���� 100��ʱ���� 0.40 mol NO2 ������� 2 L ���ܱ������У��������·�Ӧ��2NO2(g)![]() N2O4(g) H < 0����ⷴӦ����������ݣ�
N2O4(g) H < 0����ⷴӦ����������ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
����˵����ȷ����
A.0~20 s �ڣ�v(NO2) = 0.005 mol��L-1.s-1
B.��������Ӧ�� 120��ʱ���У���Ӧ�� 80 s ʱ��n(N2O4) < 0.08 mol
C.��������ʼʱ���� NO2 �������� 0.80 mol����ƽ��ʱ NO2 ת���ʽ�����
D.59 s ʱ��c(NO2)һ������ 0.12 mol��L-1