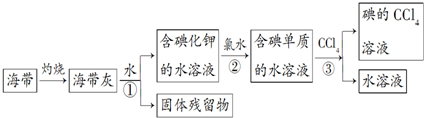
题目内容
5.以下说法正确的是( )| A. | 物质所含元素化合价升高的反应叫还原反应 | |
| B. | 能通过化合反应制得FeCl2和Fe(OH)3 | |
| C. | 某元素由化合态变为游离态,则它一定被还原 | |
| D. | 有单质参加的化学反应一定都是氧化还原反应 |
分析 A.化合价升高被氧化;
B.FeCl2与Fe反应生成FeCl3,Fe(OH)2与氧气、水化合生成Fe(OH)3;
C.由化合态变为游离态,元素的化合价可能升高,也可能降低;
D.有单质参加的反应不一定存在化合价的变化.
解答 解:A.物质所含元素化合价升高被氧化,属于氧化反应,故A错误;
B.FeCl2与Fe发生化合反应生成FeCl3,Fe(OH)2与氧气、水发生化合反应生成Fe(OH)3,故B正确;
C.由化合态变为游离态元素的化合价可能升高,也可能降低,可能被氧化,也可能被还原,故C错误;
D.有单质参加的反应不一定存在化合价的变化,如氧气转化为臭氧,故D错误;
故选B.
点评 本题考查氧化还原反应,侧重基本概念的考查,明确反应中氧化还原反应中氧化剂、还原剂与化合价的变化及反应的特征即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列关于物质分类的表述,正确的说法是( )
| A. | 根据分散质粒子能否透过滤纸,可以将分散系分为溶液、胶体和浊液 | |
| B. | 根据某物质中是否含有氢元素,判断该物质是否属于酸 | |
| C. | 根据化学反应前后,是否有电子转移,判断反应是否属于氧化还原反应 | |
| D. | 根据某物质中是否含有氧元素,可以判断该物质是否属于氧化物 |
16.下列有关物质分类和氧化还原的描述正确的是( )
| A. | 酸性氧化物一定是非金属氧化物,混合物、分散系、胶体有从属关系 | |
| B. | 元素的单质可由氧化或还原含该元素的化合物来制得 | |
| C. | 得电子越多的氧化剂,其氧化性就越强;含最高价元素的化合物一定具有强的氧化性 | |
| D. | 烧碱、熟石灰均属于碱,酸、碱、盐之间发生的反应均属于复分解反应 |
13.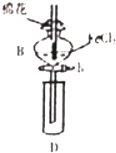 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
I.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,停止通气
Ⅱ.打开活寒b,使约2ml的溶液流入D试管中,检验D溶液中的离子
Ⅲ.接着再向B中通入一定量的SO2气体
IV.更新试管D,重复过程Ⅱ,检验取出溶液中的离子
(1)仪器B的名称是分液漏斗,棉花中浸润的溶液为NaOH溶液的是吸收Cl2、SO2,防尾气污染环境
(2)实验室制备氯气的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4molHCl,转移的电子数是2NA
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.过程ⅠV中检验取出溶液中足否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,其中一定能够证明SO、Fe2+和Cl-还原性强弱关系的是乙、丙:则SO2、Fe2+和Cl-还原性强弱顺序是SO2>Fe2+>Cl-
 某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:I.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,停止通气
Ⅱ.打开活寒b,使约2ml的溶液流入D试管中,检验D溶液中的离子
Ⅲ.接着再向B中通入一定量的SO2气体
IV.更新试管D,重复过程Ⅱ,检验取出溶液中的离子
(1)仪器B的名称是分液漏斗,棉花中浸润的溶液为NaOH溶液的是吸收Cl2、SO2,防尾气污染环境
(2)实验室制备氯气的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中消耗4molHCl,转移的电子数是2NA
(3)过程Ⅲ中一定发生反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.过程ⅠV中检验取出溶液中足否含有硫酸根的操作是取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无
(4)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,其中一定能够证明SO、Fe2+和Cl-还原性强弱关系的是乙、丙:则SO2、Fe2+和Cl-还原性强弱顺序是SO2>Fe2+>Cl-
| 过程Ⅱ中检出离子 | 过程ⅠV中检出离子 | |
| 甲 | 有 Fe3+无 Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有S042- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
20.常温下,下列有关溶液的pH或微粒的物质的量浓度关系的判断不正确的是( )
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7 | |
| B. | 某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+) |
17.下列属于吸热反应同时又属于氧化还原反应的是( )
| A. | 点燃的镁条在二氧化碳中继续燃烧 | B. | Ca(OH)2与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 酸碱中和反应 |
14.化学与科学、技术、生产、生活密切相关.下列有关说法中不正确的是( )
| A. | “血液透析”利用了胶体的性质 | |
| B. | 华裔科学家高琨因在光纤传输信息领域中取得突破性成就而获得诺贝尔奖,光纤的主要成分是高纯度的二氧化硅 | |
| C. | 玻璃钢是一种合金,广泛用于汽车车身 | |
| D. | 只要符合限量,“亚硝酸盐”、“食用色素”、“苯甲酸钠”可以作为某些食品的添加剂 |