题目内容
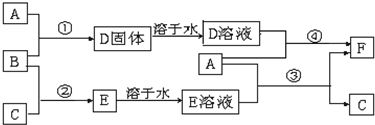
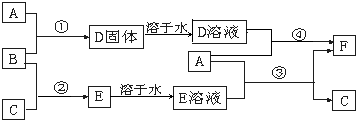
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示.
请回答:
(1)写出B物质的化学式:
(2)写出第③步反应的化学方程式为
(3)第④步反应中溶液颜色的变化
(4)写出SO2和B反应的离子方程式
(5)F溶液中滴入NaOH溶液可能产生的实验现象是

请回答:
(1)写出B物质的化学式:
Cl2
Cl2
;F的名称:氯化亚铁
氯化亚铁
.(2)写出第③步反应的化学方程式为
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
.(3)第④步反应中溶液颜色的变化
溶液由黄色变为浅绿色
溶液由黄色变为浅绿色
;写出第④步反应的离子方程式2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(4)写出SO2和B反应的离子方程式
SO2+Cl2+2H2O=4H++SO42-+2Cl-
SO2+Cl2+2H2O=4H++SO42-+2Cl-
.(5)F溶液中滴入NaOH溶液可能产生的实验现象是
先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色
先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色
.分析:A是用途最广的金属,则A为Fe;D溶液中滴加KSCN溶液显红色,则D中含有铁离子,B是常见气体单质,且具有强氧化性,所以B应为Cl2,依次推出D为FeCl3,F为FeCl2;结合转化关系图可知,Fe和E溶液反应生成FeCl2和C,则E为HCl,C为H2,最后结合化学用语及反应的现象来解答.
解答:解:A是用途最广的金属,则A为Fe;D溶液中滴加KSCN溶液显红色,则D中含有铁离子,B是常见气体单质,且具有强氧化性,所以B应为Cl2,依次推出D为FeCl3,F为FeCl2;结合转化关系图可知,Fe和E溶液反应生成FeCl2和C,则E为HCl,C为H2,
(1)由上述推断可知,B为Cl2,F为氯化亚铁,故答案为:Cl2;氯化亚铁;
(2)第③步反应为Fe与盐酸反应生成氯化亚铁和氢气,化学方程式为Fe+2HCl=FeCl2+H2↑,
故答案为:Fe+2HCl=FeCl2+H2↑;
(3)第④步反应为Fe与氯化铁反应生成氯化亚铁,离子反应为2Fe3++Fe=3Fe2+,观察到现象为溶液由黄色变为浅绿色,故答案为:溶液由黄色变为浅绿色;2Fe3++Fe=3Fe2+;
(4)B为Cl2,与SO2反应生成硫酸和盐酸,离子反应为SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(5)F为FeCl2,其溶液中滴入NaOH溶液反应生成氢氧化亚铁白色沉淀,最终被氧化物红褐色的氢氧化铁沉淀,观察到现象为先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色,
故答案为:先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色.
(1)由上述推断可知,B为Cl2,F为氯化亚铁,故答案为:Cl2;氯化亚铁;
(2)第③步反应为Fe与盐酸反应生成氯化亚铁和氢气,化学方程式为Fe+2HCl=FeCl2+H2↑,
故答案为:Fe+2HCl=FeCl2+H2↑;
(3)第④步反应为Fe与氯化铁反应生成氯化亚铁,离子反应为2Fe3++Fe=3Fe2+,观察到现象为溶液由黄色变为浅绿色,故答案为:溶液由黄色变为浅绿色;2Fe3++Fe=3Fe2+;
(4)B为Cl2,与SO2反应生成硫酸和盐酸,离子反应为SO2+Cl2+2H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+2H2O=4H++SO42-+2Cl-;
(5)F为FeCl2,其溶液中滴入NaOH溶液反应生成氢氧化亚铁白色沉淀,最终被氧化物红褐色的氢氧化铁沉淀,观察到现象为先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色,
故答案为:先生成灰白色沉淀,立即变成灰绿色,最后变成红褐色.
点评:本题考查无机物的推断,利用物质的性质及转化关系图来推断物质是解答的关键,注意A、D为解答本题的突破口,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目