题目内容
【题目】氨气是极易溶于水的气体,常温常压下,1体积水大约能溶解700体积的氨气。
(1)实验室可在浓氨水中加入固体NaOH快速制取氨气,请用化学平衡移动原理简述原因___。
(2)甲、乙两瓶氨水的浓度分别为1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中c(OH-)之比___(填“>”、“<”或“=”)10。
(3)向10mL0.1mol/L的氨水中逐滴加入20mL0.1mol/L的醋酸,溶液导电性的变化是___。写出二者反应的离子方程式:___。
【答案】在浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动 < 先增强后减弱 NH3·H2O+CH3COOH=NH4++CH3COO-+H2O
NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动 < 先增强后减弱 NH3·H2O+CH3COOH=NH4++CH3COO-+H2O
【解析】
(1)在浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,当加入固体NaOH后,c(OH-)变大,促使平衡逆向移动,氢氧化钠固体溶解放热,同时溶液温度升高,使一水合氨分解生成氨气,都促使平衡逆向移动,
NH4++OH-,当加入固体NaOH后,c(OH-)变大,促使平衡逆向移动,氢氧化钠固体溶解放热,同时溶液温度升高,使一水合氨分解生成氨气,都促使平衡逆向移动,
故答案为:在浓氨水中存在NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动;
NH4++OH-,当加入固体NaOH后,c(OH-)变大,同时溶液温度升高,都促使平衡逆向移动;
(2)甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲瓶氨水的浓度是乙瓶氨水的浓度的10倍,又弱电解质的浓度越小,电离程度越大,故甲瓶氨水的电离度比乙瓶氨水的电离度小,所以甲、乙两瓶氨水中c(OH-)之比小于10。
故答案为:<;
(3)氨水为弱电解质,开始导电性不强,滴入醋酸,反应生成醋酸铵,为强电解质,离子浓度增大,导电性增强,反应完全后,反应为NH3·H2O+CH3COOH═NH4++CH3COO-+H2O,继续滴入醋酸,溶液体积变大,离子浓度减小,导电性又逐渐减弱,
故答案为:先增强后减弱 NH3·H2O+CH3COOH═NH4++CH3COO-+H2O。

【题目】海洋动物海鞘中含有种类丰富、结构新颖的次生代谢产物,是海洋抗肿瘤活性物质的重要来源之一。一种从海鞘中提取具有抗肿瘤活性的天然产物的流程如下:
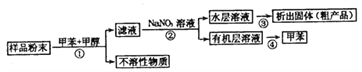
下列关于该流程中各步骤的说法中,错误的是( )
选项 | 步骤 | 采用装置 | 主要仪器 |
A | ① | 过滤装置 | 漏斗 |
B | ② | 分液装置 | 分液漏斗 |
C | ③ | 蒸发装置 | 坩埚 |
D | ④ | 蒸馏装置 | 蒸馏烧瓶 |
A. A B. B C. C D. D
【题目】碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
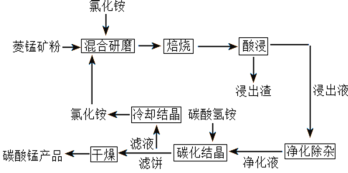
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下,Ksp(CaF2)=1.46×1010,Ksp(MgF2)=7.42×1011;Ka(HF)=1.00×104
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
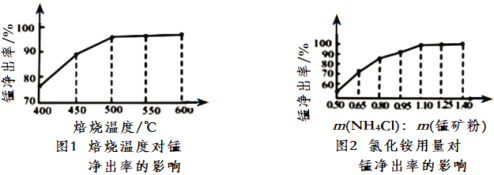
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
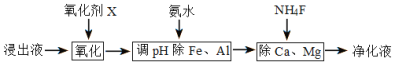
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为_________________
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,![]() =______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
=______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________
【题目】在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应CO(g)+2H2(g)CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如下表所示。下列说法正确的是( )
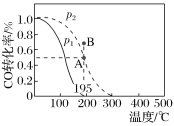
p2和195 ℃时n(H2)
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A.p2和195 ℃时,0~3 min,反应速率v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
B.p1<p2,ΔH>0
C.195 ℃、p2时,在B点:v正>v逆
D.在p2和195 ℃时,该反应的平衡常数为25