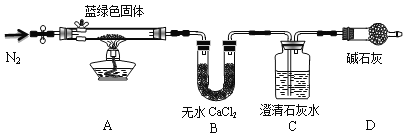
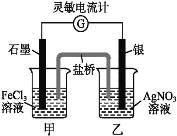
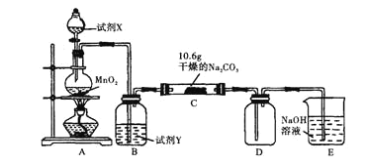
题目内容
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为_________,中心原子的杂化形式为______;d的最高价氧化物分子构型为__________,中心原子的杂化形式为_______。
(2)g位于第________族,属于________区。写出其基态原子的电子排布式_____________________________。
(3)将f的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子,请写出生成此配离子的离子方程式:_______________________________________。
(4)CH3+、—CH3、CH3— 都是重要的有机反应中间体,有关它们的说法正确的是___________。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH3—与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH3+中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3或一个CH3+和一个CH3—结合均可得到CH3CH3
【答案】三角锥形 sp3 平面正三角形 sp2 ⅡB ds 1s22s22p63s23p63d104s2或 [Ar]3d104s2 Cu2++4H2O=[Cu(H2O)4]2+ CDE
【解析】
根据元素在周期表中的位置知,a-g分别是N、F、Al、S、Cl、Cu、Zn元素,
(1)a是N元素,a的氢化物是氨气,氨气分子中N原子价层电子对个数是3且含有一个孤电子对,根据价层电子对互斥理论判断N原子杂化方式、氨气分子空间构型;
d是S元素,S元素的最高价氧化物是三氧化硫,三氧化硫分子中价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断三氧化硫分子空间构型及原子杂化方式;
(2)g为Zn,为30号元素;位于第ⅡB族,属于ds区;
(3)硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+;
(4)甲烷去掉一个氢原子后为甲基—CH3,甲基再失去一个电子为CH3+、得到一个电子为CH3—,很明显它们不是等电子体的关系;由VSEPR模型可知,CH3—为三角锥形、CH3+为平面三角形,中心原子分别为sp3和sp2杂化。
根据元素在周期表中的位置知,a-g分别是N、F、Al、S、Cl、Co、Cu元素,
(1)a是N元素,a的氢化物是氨气,氨气分子中N原子价层电子对个数是3且含有一个孤电子对,根据价层电子对互斥理论知N原子杂化方式为sp3、氨气分子空间构型为三角锥形;
d是S元素,S元素的最高价氧化物是三氧化硫,三氧化硫分子中价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知三氧化硫分子空间构型为平面正三角形,S原子杂化方式sp2;
(2)g为Zn,为30号元素;位于第ⅡB族,属于ds区;其基态原子的电子排布式为1s22s22p63s23p63d104s2或 [Ar]3d104s2;
(3)f为Cu,硫酸铜溶于水,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,离子方程式为Cu2++4H2O=[Cu(H2O)4]2+;
(4)A.甲烷分子变成CH3+、—CH3、CH3—时,失去的分别是氢负离子、氢原子和氢离子(质子),空间构型也不再与原来的分子相同,选项A错误;
B.CH3+、—CH3、CH3—分别具有6个、7个和8个价电子,不是等电子体,中心碳原子的价层电子对数不同,故空间构型不同,选项B错误;
C.CH3—与NH3、H3O+均具有10个电子,互为等电子体,几何构型均为三角锥形,选项C正确;
D.CH3+中的碳原子采取sp2杂化,所有原子均共面,选项D正确;
E.两个CH3-或一个CH3+和CH3-结合可得到CH3CH3,选项E正确。
答案选CDE。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案