题目内容
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为________________;
(2)Y元素原子的价层电子的轨道表示式为________;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________;
(4)比较X的氢化物与同族第二、三周期元素所形成的氢化物、沸点高低并说明理由________________.
(5)将Y2、Z2按下图所示通入某燃料电池中,其中b电极的电极反应式为________________.
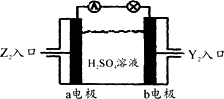
答案:
解析:
解析:
|
(1)1s22s22p63s23p63d104s24p3 (2) (3)As2O3+6Zn+6H2SO4 (4)NH3>AsH3>PH3,NH3中分子间可形成氢键,沸点反常,AsH3相对分子质量比Ph3大,分子间作用力较大,沸点较高. (5)O2+4e-+4H+ |

练习册系列答案
相关题目
 2AsH3↑+6ZnSO4+3H2O
2AsH3↑+6ZnSO4+3H2O 2H2O
2H2O

