题目内容
15.在容积固定的密闭容器中,进行下列反应A(g)+B(g)?2C(?)+D(g),此反应符合下列两个图象(其中φ代表物质的百分含量),则下列判断正确的是( )
| A. | 物质C不可能为气态 | |
| B. | 正反应为吸热反应 | |
| C. | 该反应,升高温度平衡正向移动 | |
| D. | 300℃下该反应到达平衡状态后,迅速充入He,平衡正向移动 |
分析 根据压强与B%的图象可知,压强增大,B的含量减小,平衡向着正向移动,说明该反应是气体体积减小的反应,据此可知C一定不是气体;由温度与D%的图象可知,升高温度,D%减小,说明升高温度平衡向着逆向移动,该反应为放热反应,据此进行解答.
解答 解:由图中压强对B%的影响可知,压强增大,B的含量反而减小,说明正反应是体积减小的反应,增大压强,平衡向着正向移动,故C的状态为固体或者液体;再根据温度对D%的影响可知,温度越高,D的含量越小,说明升高温度,平衡向着逆向移动,该反应为放热反应,
根据以上分析可知,正反应为放热反应,C是固体或液体.
A、物质C不可能为气态,为固体或者液体,故A正确;
B、正反应为放热反应,故B错误;
C、正反应为放热反应,升高温度平衡逆向移动,故C错误;
D、反应到达平衡状态后,迅速充入He,各组分的浓度不变,所以平衡不移动,故D错误.
故选A.
点评 本题考查了产物百分含量随温度、时间变化的曲线,题目难度中等,注意掌握影响化学平衡的因素,学会根据化学平衡曲线分析反应物、生成物状态及反应中焓变,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
5.X、Y、Z、W是原子序数依次递增的短周期元素,4种元素的原子最外层电子数之和为16,X与其它元素不在同一周期和同一主族,Y的阴离子与Z的阳离子具有相同的电子层结构,且Z为地壳中含量最高的金属元素,W原子得到一个电子后形成与某稀有气体原子核外电子排布相同的稳定结构.下列说法不合理的是( )
| A. | 简单离子半径:W>Y>Z | |
| B. | X、Y与Z形成的化合物中既有极性共价键又有离子键 | |
| C. | Z与Y形成的化合物为一种高温结构陶瓷 | |
| D. | X与Y只能形成10电子分子,不能形成18电子分子 |
6.水溶液中能大量共存的一组离子是( )
| A. | Na+、Ca2+、Cl-、SO${\;}_{4}^{2-}$ | B. | Fe2+、H+、SO${\;}_{3}^{2-}$、ClO- | ||
| C. | K+、Fe3+、NO${\;}_{3}^{-}$、SCN- | D. | Mg2+、NH${\;}_{4}^{+}$、Cl-、SO${\;}_{4}^{2-}$ |
10.下列说法错误的是( )
| A. | 使用分液漏斗、容量瓶前都应先检漏 | |
| B. | 用托盘天平可以称取25.12g NaCl固体 | |
| C. | 仰视量筒刻度线量取浓硫酸配成的稀硫酸浓度偏高 | |
| D. | 不用任何试剂可以鉴别开NaOH、MgSO4、Ba(NO3)2、Cu(NO3)2、KNO3 五种溶液 |
20.已知氯气和NaOH在一定温度下能发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,3Cl2+6NaOH=5NaCl+NaClO3+3H2O.某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合溶液.经测定ClO-与ClO3-的物质的量之比为1:3,则氯气与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
| A. | 21:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
4.某烯烃氢化后得到的饱和烃如下:CH3- CH2-CH2-
CH2-CH2- CH3,该烃可能的结构有( )
CH3,该烃可能的结构有( )
 CH2-CH2-
CH2-CH2- CH3,该烃可能的结构有( )
CH3,该烃可能的结构有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
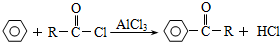
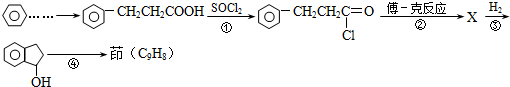
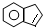 .
.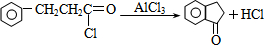 .
.