题目内容
下列说法正确的是
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
C
解析试题分析:A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),是因为难溶的向更难溶的转化。则Ksp(PbS)>Ksp(CuS)。错误。B.在NaHS溶液中,存在电离平衡:HS- H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,所以电离平衡正向移动,c(H+)增大,则pH减小。C.TiCl4是强酸弱碱盐,水解消耗水电离产生的OH-,产生Ti(OH)4.水解反应是吸热反应,所以加热条件下可促进TiCl4水解,产生更多的Ti(OH)4。然后过滤、洗涤Ti(OH)4,加热分解就可以制备TiO2固体。正确。D.铜制器皿放置过程中会生成铜绿是因为发生了反应:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。错误。
H++S2-,当向其中加入少量CuCl2粉末时,发生反应:Cu2++S2-=CuS↓产生黑色沉淀,由于消耗了S2-,所以电离平衡正向移动,c(H+)增大,则pH减小。C.TiCl4是强酸弱碱盐,水解消耗水电离产生的OH-,产生Ti(OH)4.水解反应是吸热反应,所以加热条件下可促进TiCl4水解,产生更多的Ti(OH)4。然后过滤、洗涤Ti(OH)4,加热分解就可以制备TiO2固体。正确。D.铜制器皿放置过程中会生成铜绿是因为发生了反应:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。错误。
考点:考查沉淀的转化、弱电解质的电离、盐的水解和金属的腐蚀等知识。

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
在Na2S溶液中下列关系不正确的是( )
| A.c(Na+)=2c(HS-)+c(S2-)+c(H2S) |
| B.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C.c(Na+)> c(S2-)>c(OH-)>c(HS-) |
| D.c(OH-)=c(HS-)+c(H+)+2c(H2S) |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中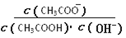 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH<7 |
现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
100℃时,下列各溶液中,离子的物质的量浓度关系正确的是:
| A.pH=11的氨水中:c(OH-)=3.0mol·L-1 |
| B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)=c(CH3COO-) |
| C.pH=2的稀盐酸中,c(H+)=c(Cl-) |
| D.pH=8的Na2SO3溶液中,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) |
下列说法正确的是
| A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大 |
| B.1 mol·L-1的NH4Cl溶液中含有NH4+的数目一定小于NA |
| C.用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-=2Fe(OH)3↓+3H2↑ |
| D.将带有相反电荷的胶体混合,一定会出现胶体聚沉现象 |
T℃时,CaCO3和CaF2的Ksp分别为1.0 ×10-10。和4.0 ×10-12。下列说法正确的是
| A.T℃时,两饱和溶液中c(Ca2+ ):CaCO3>CaF2 |
| B.T℃时,两饱和溶液等体积混合,会析出CaF2固体 |
| C.T℃时,CaF2固体在稀盐酸中的Ksp比在纯水中的Ksp大 |
| D.T℃时,向CaCO3悬浊液中加NaF固体,可能析出CaF2固体 |
有0.1 mol 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
| A.溶液①中,C(CH3COO-)=C(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的C(CH3COO-) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+ c(CH3COOH)= C(Na+) |
| D.溶液①、③等体积混合,混合液中C(Na+)>C(CH3COO-)> C(H+)>C(OH-) |
 H+ + A2- (Ka=1.0×10-2),下列说法正确的是
H+ + A2- (Ka=1.0×10-2),下列说法正确的是