��Ŀ����
11��ͼ����һ�����¶Ⱥ�ѹǿ��N 2�� H2��Ӧ���� 1mol NH3�����������仯ʾ��ͼ����д����ҵ�ϳɰ����� ��ѧ����ʽ����H ����ֵ�ú���ĸ Q1��Q2 �Ĵ���ʽ��ʾ����N2 ��g��+3H2��g���T2NH3��g����H=2��Q2-Q1�� kJ•mol-1��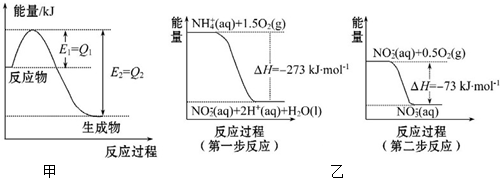
��1���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2 �ڴ������������� Fe2O3 �� TiO2��������ˮ�������з�Ӧ��
��֪��
N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1��
2H2��g��+O2��g��?2H2O��l����H=-571.6kJ•mol1��
�� 2N2��g��+6H2O��l��?4NH3��g��+3O2��g����H=-1530kJ•mol-1��
��2������ˮ�е� NO3-��Ҫ������ NH4+����֪������������£�NH4+����������Ӧ�������� NO3-��������Ӧ�������仯ʾ��ͼ��ͼ�ң�1molNH4+ȫ���������� NO3-���Ȼ�ѧ����ʽΪNH4+ ��aq��+2O2��g��=2H+��aq��+NO3- ��aq��+H2O��l����H=-346 kJ•mol-1��
���� ��ͼ��֪��N2��H2��Ӧ����1molNH3�ų�������Ϊ��Q2-Q1��kJ��ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
��1����֪����N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1��
��2H2��g��+O2��g��?2H2O��l����H=-571.6kJ•mol1��
���ݸ�˹���ɣ���֪�١�2-�ڡ�3�ɵã�2N2��g��+6H2O��l��?4NH3��g��+3O2��g������Ӧ��Ҳ������Ӧ�ļ��㣻
��2����ͼ��֪����һ���Ȼ�ѧ��ӦΪ��NH4+ ��aq��+$\frac{3}{2}$O2��g��=2H+��aq��+NO2- ��aq��+H2O��l����H=-273kJ•mol-1���ڶ����Ȼ�ѧ��ӦΪ��NO2- ��aq��+$\frac{1}{2}$O2��g��=NO3- ��aq������H=-73kJ•mol-1�����ø�˹���ɿɼ���1mol NH4+��aq��ȫ��������NO3- ��aq�����Ȼ�ѧ����ʽ��
��� �⣺��ͼ��֪��N2��H2��Ӧ����1molNH3�ų�������Ϊ��Q2-Q1��kJ���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽΪ��N2��g��+3H2��g��?2NH3��g����H=-2��Q2-Q1��kJ•mol-1��
�ʴ�Ϊ��N2 ��g��+3H2��g���T2NH3��g����H=2��Q2-Q1�� kJ•mol-1��
��1����֪����N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1��
��2H2��g��+O2��g��?2H2O��l����H=-571.6kJ•mol1��
���ݸ�˹���ɣ���֪�١�2-�ڡ�3�ɵã�2N2��g��+6H2O��l��?4NH3��g��+3O2��g�����ʡ�H=2����-92.4kJ•mol-1��-3����-571.6kJ•mol-1��=-1530kJ•mol-1��
�ʴ�Ϊ��-1530kJ•mol-1��
��3����ͼ��֪����һ���Ȼ�ѧ��ӦΪ��NH4+ ��aq��+$\frac{3}{2}$O2��g��=2H+��aq��+NO2- ��aq��+H2O��l����H=-273kJ•mol-1 �٣�
�ڶ����Ȼ�ѧ��ӦΪ��NO2- ��aq��+$\frac{1}{2}$O2��g��=NO3- ��aq������H=-73kJ•mol-1 �ڣ�
�ɸ�˹���ɿ�֪��+�ڵ�1mol NH4+��aq��ȫ��������NO3- ��aq�����Ȼ�ѧ����ʽΪ��NH4+ ��aq��+2O2��g��=2H+��aq��+NO3- ��aq��+H2O��l����H=-346 kJ•mol-1��
�ʴ�Ϊ��NH4+ ��aq��+2O2��g��=2H+��aq��+NO3- ��aq��+H2O��l����H=-346 kJ•mol-1��
���� ���⿼���˹����Ӧ�ã��漰�Ȼ�ѧ����ʽ��д����Ӧ���йؼ���ȣ��ѶȲ���ע��Ը�˹���ɵ����⣮

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д� �Ͻ�ƽ���Ȿϵ�д�
�Ͻ�ƽ���Ȿϵ�д�| A�� | �������ɼ��Լ���ɵķǼ��Է��� | |
| B�� | �����ܷ����ӳɷ�Ӧ��ȡ����Ӧ | |
| C�� | ��������ʹKMnO4������Һ��ɫ | |
| D�� | �����Ķ���ȡ������3��ͬ���칹�� |
| A�� | ��״���£�22.4LCH4�к���ԭ����ĿԼΪNA | |
| B�� | ��״���£�NA��H2O���ӵ����ԼΪ22.4L | |
| C�� | ���³�ѹ�£�NA��D2O���ӵ�����ԼΪ20g | |
| D�� | 1L 0.5mol/L AlCl3��Һ�к��е�Al3+��ĿԼΪNA |
| A�� | CO2��N2OĦ��������� | |
| B�� | 18gˮ�к���1molH2O | |
| C�� | O2��Ħ����������λ��g•mol-1������ֵ�ϵ�������Է������� | |
| D�� | 1mol•L-1NaCl��Һ�к�1molNa+ |
| A�� | ��ʹ��ˮ����ɫ���ڼӳɷ�Ӧ | |
| B�� | ��ϩ��ˮ��Ӧ�����Ҵ�����ˮ�ⷴӦ | |
| C�� | ͬ���ױ�ֻ��һ�ֽṹ˵���������в����ڵ�˫������ | |
| D�� | �����������飨C4H8������ϩ��C2H4����ȫȼ�գ����ĵ���������� |
 ʵ������Ҫ0.1mol/LNaOH��Һ500mL������������Һ����������ش��������⣮
ʵ������Ҫ0.1mol/LNaOH��Һ500mL������������Һ����������ش��������⣮