题目内容
6.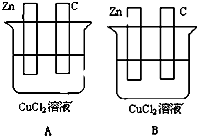 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:(1)在A图中画出必要的连线或装置,使连接后的装置为原电池.电极反应方程式:锌板:Zn-2e=Fe2+;碳棒:Cu2++2e=Cu.
(2)在B图中画出必要的连线或装置,使连接后的装置,
为电解池并使锌板上有红色物质生成出,则电极反应方程式,
锌板:Cu2+-2e=Cu;
碳棒:2Cl--2e-=Cl2↑.
经过一段时间后,溶液中的Cu2+浓度减小(增大、减小、不变.)
分析 (1)原电池的构成条件:活泼性不同的两个电极,闭合回路,电解质溶液;自发的氧化还原反应,负极上是金属失电子的氧化反应,正极上是得电子的还原反应;
(2)电解池中有金属析出的电极是阴极,根据电极现象确定电极,并书写电极反应.
解答 解:(1)将装置A连接后成为原电池,则根据原电池的构成条件,缺少闭合回路这一条件,只需将两个电极连接即可,活泼金属锌为负极,该极上发生失电子的氧化反应,即Zn-2e=Zn2+,C棒是正极,该极上是铜离子的电子的还原反应,即Cu2++2e=Cu,
故答案为: ;Zn-2e=Fe2+;Cu2++2e=Cu;
;Zn-2e=Fe2+;Cu2++2e=Cu;
(2)连接后的装置为电解池,锌板上有红色物质生成,所以锌板是阴极,该极上发生还原反应:Cu2+-2e=Cu,铜棒是阳极,属于活泼金属电极,该极上是氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,溶液中的Cu2+浓度减小,
故答案为: ;Cu2+-2e=Cu;2Cl--2e-=Cl2↑;减小.
;Cu2+-2e=Cu;2Cl--2e-=Cl2↑;减小.
点评 本题考查了原电池和电解池原理的简单应用,注意活泼金属作电解池阳极时,阳极上电极材料放电而不是溶液中阴离子放电,注意把握电极方程式的书写方法,题目难度不大.

练习册系列答案
相关题目
17.下列各组物质性质的比较中,有一组的递变规律与其他不同的是( )
| A. | 还原性Cl-、Br-、I- | B. | 碱性:Na0H、Mg(OH)2、Al(OH)3 | ||
| C. | 稳定性HCl、H2S、PH3 | D. | 酸性:HC1O4、H2SO4、H2CO3 |
1.下列反应属于吸热反应的是( )
| A. | 稀硫酸与氢氧化钾溶液反应 | B. | 碳与二氧化碳的反应 | ||
| C. | 锌与稀硫酸的反应 | D. | 生石灰变成熟石灰的反应 |
18.在一定温度下的密闭固定容积容器中,当下列物理量不再变化时,表明A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的平均相对分子质量 | ||
| C. | 混合气体的分子数目 | D. | 混合气体的总物质的量 |
15.你认为在常温下的22.4L空气所占的体积与下列哪个的体积最为相近( )
| A. | 苹果 | B. | 口杯 | C. | 篮球 | D. | 大象 |
16.将10mL 5mol/L 的MgCl2 稀释到200mL,稀释后溶液中Cl-的物质的量浓度为( )
| A. | 0.5 mol/L | B. | 0.25 mol/L | C. | 0.1 mol/L | D. | 1 mol/L |